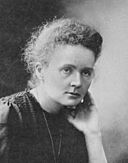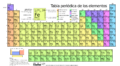Química para niños

La química es una ciencia natural que estudia la materia: de qué está hecha, cómo se organiza y qué propiedades tiene. También investiga los cambios que la materia experimenta durante las reacciones químicas y cómo se relaciona con la energía química. Imagina que la química es como una detective que descubre los secretos de todo lo que nos rodea, desde el aire que respiramos hasta los alimentos que comemos.
A menudo se le llama la «ciencia central» porque conecta muchas otras ciencias naturales. Por ejemplo, se une con la física en la fisicoquímica, con la biología en la bioquímica, con la astronomía en la astroquímica y con la geología en la geoquímica. La mayoría de los procesos químicos se pueden estudiar en un laboratorio usando herramientas y técnicas especiales. También se pueden usar computadoras para crear modelos y entender mejor estos procesos.
La química moderna nació de la alquimia, una práctica antigua que mezclaba ideas de química, física y otras áreas, pero que también realizaba experimentos. Esta etapa terminó con la revolución química, gracias a descubrimientos como los de los gases por Robert Boyle y la ley de conservación de la materia de Antoine Lavoisier. La química se organizó mejor con la creación de la tabla periódica de los elementos y la teoría atómica, lo que ayudó a entender los estados de la materia, los iones, los enlaces químicos y las reacciones químicas. Desde el siglo XIX, la química ha impulsado una gran industria química que es muy importante para nuestra economía y calidad de vida.
Las diferentes áreas de la química se agrupan según el tipo de materia que estudian o el tipo de investigación que hacen. Algunas de las más importantes son la química inorgánica (que estudia la materia sin carbono), la química orgánica (que estudia la materia con carbono), la bioquímica (que estudia las sustancias en los seres vivos), la fisicoquímica (que analiza los aspectos físicos de los sistemas químicos) y la química analítica (que investiga la composición y estructura de las sustancias).
Contenido
- ¿De dónde viene la palabra "química"?
- ¿Cómo ha cambiado la definición de química?
- ¿Por qué es importante la química?
- ¿Cómo ha evolucionado la química?
- Principios clave de la química moderna
- Ramas de la química
- Grandes mentes de la química
- Químicos destacados y el Premio Nobel
- El átomo: el corazón de la química
- Conceptos fundamentales de la química
- Galería de imágenes
- Véase también
¿De dónde viene la palabra "química"?
La palabra química viene de «alquimia», un nombre antiguo para un conjunto de prácticas que combinaban ciencia con otras ideas como la metalurgia, la astronomía y la medicina. Los alquimistas, que existieron desde hace mucho tiempo (alrededor del año 330), no solo buscaban hacer oro, sino que también estudiaban cómo se formaban y cambiaban las cosas. A un alquimista se le llamaba a menudo «químico». Más tarde, en 1661, con la publicación del libro El químico escéptico de Robert Boyle, el término química se usó oficialmente para referirse a esta ciencia.
La palabra alquimia viene del árabe al-kīmīā, que a su vez viene del griego khemia o khemeia. Una idea es que viene de la palabra Chemi o Kimi, el nombre antiguo de Egipto, lo que significaría "el arte egipcio". Otra idea es que viene del griego que significa «fusionar». Una tercera hipótesis, más aceptada hoy, es que viene del griego khumos, que significa "jugo de una planta", y podría referirse al "arte de extraer jugos", como los metales, es decir, la metalurgia.
¿Cómo ha cambiado la definición de química?
La definición de química ha evolucionado con el tiempo, a medida que se han hecho nuevos descubrimientos.
- En 1661, el científico Robert Boyle dijo que la química estudiaba los principios de los cuerpos mezclados.
- En 1663, Christopher Glaser la definió como el arte de disolver cuerpos, obtener sus sustancias y unirlas para mejorarlas.
- En 1745, Georg Ernst Stahl la vio como el arte de entender las mezclas y compuestos hasta sus partes más básicas, y luego volver a formarlos.
- En 1857, Jean-Baptiste Dumas la consideró la ciencia que se ocupa de las leyes y efectos de las fuerzas entre moléculas.
- En 1947, Linus Pauling la definió como la ciencia que estudia las sustancias: su estructura, propiedades y cómo se transforman en otras.
- Más recientemente, en 1988, el profesor Raymond Chang la amplió a «el estudio de la materia y los cambios que implica».
¿Por qué es importante la química?
La química es una de las ciencias básicas porque está presente en casi todas las ciencias naturales. Es muy importante en campos como la ciencia de materiales, la biología, la farmacia, la medicina, la geología, la ingeniería y la astronomía.
Los procesos químicos que estudia la química involucran partículas muy pequeñas como electrones, protones y neutrones, o grupos de ellas como núcleos atómicos, átomos y moléculas. También estudia estructuras más grandes como cristales y superficies.
Cuando ocurre una reacción química, las partículas intercambian energía con su entorno. En los procesos exotérmicos, se libera energía (como calor), y en los endotérmicos, se necesita energía del entorno para que ocurran.
Las principales áreas de la química son:
- Bioquímica: Es fundamental para la biotecnología y ayuda a entender problemas de salud y medio ambiente.
- Fisicoquímica: Explica los principios físicos detrás de las propiedades y el comportamiento de los sistemas químicos.
- Química analítica: Estudia la composición química de un material usando métodos de laboratorio. Se divide en cuantitativa (cuánto hay) y cualitativa (qué hay).
- Química inorgánica: Estudia los elementos y compuestos que no tienen enlaces carbono-hidrógeno, como los ácidos y las bases.
- Química orgánica: Estudia las moléculas que contienen carbono, que son la base de la vida.
- Química industrial: Se enfoca en cómo fabricar productos químicos en grandes cantidades de forma eficiente y con el menor impacto ambiental.
El electrón es una partícula clave en química. Entender cómo se distribuyen los electrones en los átomos y moléculas ha sido un gran avance, ya que esto explica cómo reaccionan las sustancias.
¿Cómo ha evolucionado la química?
La historia de la química es muy larga y está conectada con el desarrollo de la humanidad. Las civilizaciones antiguas ya sabían cómo transformar la materia. Por ejemplo, extraían metales de sus minas, hacían aleaciones como el bronce, fabricaban cerámica, esmaltes y vidrio, producían fermentaciones como la cerveza y el vino, y obtenían sustancias de plantas para medicinas o perfumes, así como jabón de las grasas.
Aunque la filosofía y la alquimia no explicaban bien la materia, los alquimistas sentaron las bases de la química moderna al hacer experimentos y registrar sus resultados. Un momento clave fue en 1661, con el libro de Robert Boyle, El químico escéptico: o las dudas y paradojas quimio-físicas. En esta obra, Boyle separó la química de la alquimia y propuso usar el método científico en los experimentos.
Se considera que la química se convirtió en una ciencia completa gracias a las investigaciones de Antoine Lavoisier y su esposa Marie Anne Pierrette Paulze. Ellos descubrieron la ley de conservación de la materia y sentaron las bases de la química. Desde el siglo XVIII, la química se ha desarrollado como una ciencia experimental moderna, con métodos de medición más precisos y el abandono de creencias sin pruebas.
La historia de la química también se relaciona con la historia de la física, especialmente con la teoría atómica y la termodinámica.
| Época del descubrimiento de los elementos químicos | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
Clave de colores: Antes del 1500 (13 elementos): Antigüedad y Edad Media. 1500-1800 (+21 elementos): casi todos en el Siglo de las Luces. 1800-1849 (+24 elementos): revolución científica y revolución industrial. 1850-1899 (+26 elementos): gracias a la espectroscopia. 1900-1949 (+13 elementos): gracias a la teoría cuántica antigua y la mecánica cuántica. 1950-2000 (+17 elementos): elementos "postnucleares" (del nº at. 98 en adelante) por técnicas de bombardeo. 2001-presente (+4 elementos): por fusión nuclear.
La química se convierte en ciencia
Gracias a nuevos métodos de experimentación, científicos como Robert Boyle, Robert Hooke y John Mayow transformaron las viejas ideas en una disciplina científica. A Boyle se le considera el padre de la química moderna. En su libro "El Químico Escéptico", diferenció la alquimia de la nueva química basada en experimentos. Él propuso la ley de Boyle y sugirió que los átomos y las reacciones químicas podían ser estudiados de forma rigurosa.
En el siglo XVIII, Georg Ernst Stahl propuso la teoría del flogisto, que decía que una sustancia llamada flogisto causaba la combustión. Sin embargo, Antoine Lavoisier la refutó a finales de siglo. Lavoisier descubrió la ley de conservación de la masa y creó un sistema para nombrar los compuestos químicos que aún usamos.
Antes de Lavoisier, ya se habían hecho descubrimientos importantes sobre el "aire". Se descubrió que el aire estaba compuesto por varios gases. Joseph Black y J. B. van Helmont descubrieron el dióxido de carbono en 1754. Henry Cavendish descubrió el hidrógeno, y Joseph Priestley y Carl Wilhelm Scheele aislaron el oxígeno puro.
En 1803, John Dalton propuso la teoría moderna de los átomos. Dijo que todas las sustancias están hechas de "átomos" indivisibles y que los átomos de diferentes elementos tienen pesos distintos.
A principios del siglo XIX, Jöns Jacob Berzelius y Humphry Davy desarrollaron la teoría electroquímica, gracias a la invención de la pila voltaica por Alessandro Volta. Davy descubrió nueve elementos nuevos, como los metales alcalinos, al extraerlos de sus óxidos con electricidad.
William Prout sugirió ordenar los elementos por su peso atómico. Más tarde, J. A. R. Newlands creó una tabla primitiva de elementos. Esta idea evolucionó hasta la tabla periódica moderna, creada por Julius Lothar Meyer y Dmitri Mendeleev en 1860. A finales de siglo, William Ramsay y lord Rayleigh descubrieron los gases nobles, completando la tabla.
La química orgánica avanzó mucho con Justus von Liebig y otros, después de que Friedrich Wohler creara urea en el laboratorio. Esto demostró que las sustancias de los seres vivos podían entenderse con la química. Otros avances importantes del siglo XIX fueron la comprensión de los enlaces de valencia (Edward Frankland, 1852) y la aplicación de la termodinámica a la química (J. W. Gibbs y Svante Arrhenius, 1870).
¿Cómo se entiende la estructura química?
En el siglo XX, se comprendieron mejor los fundamentos teóricos de la química gracias a descubrimientos sobre la estructura interna de los átomos. En 1897, J. J. Thomson descubrió el electrón. Poco después, Henri Becquerel y la pareja Pierre y Marie Curie investigaron la radiactividad. Ernest Rutherford descubrió la estructura interna del átomo y el protón, y clasificó los tipos de radiactividad.
El trabajo de Rutherford fue mejorado por sus estudiantes, Niels Bohr y Henry Moseley. La teoría de los enlaces químicos y los orbitales moleculares fue desarrollada por los científicos Linus Pauling y Gilbert N. Lewis.
El año 2011 fue declarado por las Naciones Unidas como el Año Internacional de la Química, una iniciativa para celebrar la importancia de esta ciencia.
Principios clave de la química moderna
El modelo actual de la estructura atómica se basa en la mecánica cuántica. La química tradicional estudia las partículas más pequeñas: átomos, moléculas, sustancias, metales, cristales y otros grupos de materia. La materia puede estudiarse en estado líquido, gaseoso o sólido, ya sea sola o combinada. Las interacciones y transformaciones químicas suelen ser el resultado de cómo los átomos se unen entre sí. Todo esto se investiga en un laboratorio de química.
En un laboratorio, se usan muchos materiales de vidrio, pero la experimentación química no depende solo de ellos. Gran parte de la química aplicada e industrial se hace sin cristalería.
Una reacción química es cuando algunas sustancias se transforman en una o más sustancias diferentes. Esto ocurre porque los electrones en los enlaces químicos entre los átomos se reorganizan. Se puede representar con una ecuación química, donde el número de átomos a cada lado de la ecuación debe ser igual. Si no lo es, no es una reacción química, sino una reacción nuclear o desintegración radiactiva. Las leyes químicas básicas determinan qué tipo de reacciones puede tener una sustancia y los cambios de energía que las acompañan.
La energía y la entropía (el desorden) son muy importantes en casi todos los estudios químicos. Las sustancias químicas se clasifican por su estructura, estado y composición. Se pueden analizar con herramientas como la espectroscopia y la cromatografía. Los científicos que investigan en química se llaman «químicos», y muchos se especializan en áreas específicas.
Algunos conceptos esenciales para estudiar química son:
¿Qué es la materia en química?
En química, la materia es todo lo que ocupa un espacio y tiene masa, forma, peso y volumen. Por lo tanto, se puede observar y medir. La materia es de lo que están hechos los objetos físicos y está compuesta por partículas. Estas partículas tienen masa, aunque algunas, como el fotón, no la tienen en reposo. La materia puede ser una sustancia química pura o una mezcla de varias sustancias.
¿Qué son los átomos?
El átomo es la unidad más pequeña de la química. Está formado por un centro denso llamado núcleo atómico, rodeado por una «nube de electrones». El núcleo contiene protones (con carga positiva) y neutrones (sin carga). Los electrones (con carga negativa) giran alrededor del núcleo.
En un átomo neutro, el número de electrones negativos es igual al número de protones positivos. El núcleo es muy denso; un protón o neutrón es 1836 veces más pesado que un electrón. Sin embargo, el átomo es unas 10.000 veces más grande que su núcleo.
El átomo es la parte más pequeña que mantiene las propiedades químicas de un elemento, como su capacidad para unirse con otros átomos.
¿Qué es un elemento químico?
Un elemento químico es una sustancia pura hecha de un solo tipo de átomo. Se identifica por el número de protones en el núcleo de sus átomos, llamado «número atómico» (símbolo Z). El número másico es la suma de protones y neutrones. Aunque todos los átomos de un elemento tienen el mismo número atómico, pueden tener diferentes números másicos; a estos se les llama isótopos. Por ejemplo, todos los átomos con 6 protones son de carbono, pero pueden tener un número másico de 12 o 13.
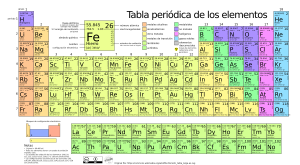
La forma estándar de organizar los elementos es en la tabla periódica, que los ordena por número atómico. La tabla periódica se organiza en grupos (columnas) y períodos (filas) y es muy útil para ver cómo cambian las propiedades de los elementos de forma regular.
¿Qué es un compuesto químico?
Un compuesto químico es una sustancia pura formada por la unión de dos o más elementos diferentes. Las propiedades de un compuesto suelen ser muy distintas de las de los elementos que lo forman. La Unión Internacional de Química Pura y Aplicada (IUPAC) establece las reglas para nombrar los compuestos. Los compuestos orgánicos e inorgánicos tienen sus propios sistemas de nomenclatura. Además, el Servicio de Resúmenes Químicos asigna un número de registro CAS a cada sustancia química para identificarla.
Ramas de la química

La química es un campo muy amplio, por lo que se divide en varias ramas para su estudio. Las seis principales son:
- Química inorgánica: Estudia los compuestos que no se basan en cadenas de carbono, como los metales, ácidos y bases.
- Química orgánica: Se enfoca en los compuestos que tienen carbono como base, que son esenciales para la vida.
- Bioquímica: Investiga las reacciones y sustancias químicas que ocurren en los seres vivos. Está muy relacionada con la química orgánica y la biología molecular.
- Química física: También llamada fisicoquímica, estudia los principios físicos que explican el comportamiento de los sistemas químicos, como la energía y la velocidad de las reacciones.
- Química industrial: Se dedica a los métodos para producir grandes cantidades de productos químicos de manera rentable y sostenible.
- Química analítica: Desarrolla métodos para identificar (qué hay) y cuantificar (cuánto hay) sustancias en una muestra.
Además de estas, existen muchas otras subdisciplinas más específicas o que combinan varias áreas:
- Astroquímica: Estudia la composición química de los astros y el material en el espacio.
- Electroquímica: Investiga la relación entre la energía eléctrica y la energía química.
- Fotoquímica: Estudia cómo la luz interactúa con átomos y moléculas.
- Magnetoquímica: Se dedica a las sustancias con propiedades magnéticas interesantes.
- Nanoquímica: Relacionada con la nanotecnología, estudia materiales a escala muy pequeña.
- Petroquímica: Se ocupa de la industria que usa petróleo o gas natural para obtener productos químicos.
- Geoquímica: Estudia las transformaciones de los minerales en la Tierra.
- Química computacional: Usa computadoras para resolver problemas químicos y predecir propiedades de moléculas.
- Química cuántica: Aplica la mecánica cuántica para entender la química.
- Química macromolecular: Estudia las moléculas muy grandes, como los polímeros.
- Química medioambiental: Investiga la influencia de los componentes químicos en la Tierra, tanto naturales como creados por el ser humano.
- Química nuclear: Estudia las propiedades y el comportamiento de los núcleos atómicos.
- Química organometálica: Se enfoca en compuestos que tienen un enlace entre carbono y un metal.
- Química supramolecular: Estudia las interacciones entre moléculas.
- Química teórica: Usa las matemáticas y la física para explicar o predecir fenómenos químicos.
- Química toxicológica: Estudia cómo las sustancias químicas, naturales o artificiales, afectan el medio ambiente y los seres vivos.
Grandes mentes de la química
Hace unos 455 años, solo se conocían doce elementos. A medida que se descubrían más, los científicos notaron que seguían un orden. Cuando los organizaron en una tabla con filas y columnas, vieron que los elementos en la misma columna tenían propiedades similares. También había espacios vacíos para elementos aún no descubiertos. Estos espacios llevaron al científico ruso Dmitri Mendeléyev a predecir la existencia del germanio (número atómico 32), e incluso su color, peso, densidad y punto de fusión. Sus predicciones sobre otros elementos como el galio y el escandio también fueron muy acertadas.
Químicos destacados y el Premio Nobel
Muchos científicos han hecho grandes contribuciones a la química y han ganado el Premio Nobel de Química. Algunos ejemplos son:
- Emil Fischer: Descubrió cómo sintetizar la glucosa y otros azúcares.
- Maria Curie: Por sus estudios sobre la radiactividad y el descubrimiento del radio y el polonio.
- Theodor Svedberg: Por inventar y aplicar la ultracentrífuga.
- Irene Curie: Hija de Marie Curie, por construir el primer reactor nuclear que usaba la fisión nuclear controlada.
- Otto Hanh: Por su descubrimiento de la fisión nuclear.
- Linus Pauling: Por su estudio de la estructura atómica de las proteínas y la anemia de células falciformes.
- Luis Federico Leloir: Por descubrir los procesos químicos que forman azúcares en las plantas.
- Paul Crutzen, Mario Molina y Sherwood Rowland: Compartieron el Nobel por descubrir el papel de los óxidos de nitrógeno y los fluorocarbonos en la destrucción de la capa de ozono.
- Roger David Kornberg: Por descubrir cómo las células copian la información genética.
- Stanley Whittingham y Akira Yoshino: Por desarrollar las baterías de iones de litio.
El átomo: el corazón de la química
La idea de que la materia está hecha de átomos se remonta a los filósofos de la Grecia antigua. Sin embargo, las pruebas científicas de la teoría atómica se deben a trabajos de científicos como Antoine Lavoisier, John Dalton y Amedeo Avogadro a principios del siglo XIX.
Los átomos son la parte más pequeña de la materia que estudia la química. Están formados por partículas con carga eléctrica: los electrones (negativos), los protones (positivos) y los neutrones (sin carga). Todas estas partículas contribuyen a la masa del átomo.
Cada átomo tiene un núcleo denso y positivo en el centro, rodeado por una nube de electrones negativos que giran a su alrededor. El núcleo está formado por protones y neutrones. El número de protones en el núcleo determina el número atómico de un elemento. Por ejemplo, el hidrógeno tiene un solo protón, por lo que su número atómico es 1 y es el elemento más ligero. La carga de un protón es igual y opuesta a la de un electrón. Un átomo es eléctricamente neutro porque tiene el mismo número de electrones que de protones.
Conceptos fundamentales de la química
Partículas básicas
Los átomos son las partes más pequeñas de un elemento (como el carbono, el hierro o el oxígeno). Todos los átomos de un mismo elemento tienen la misma estructura electrónica, que es la responsable de la mayoría de sus características químicas. Pueden variar en la cantidad de neutrones, formando isótopos. Las moléculas son las partes más pequeñas de una sustancia (como el azúcar) y están formadas por átomos unidos. Si tienen carga eléctrica, se llaman iones: cationes si son positivos y aniones si son negativos.
El mol es una unidad para contar partículas, como una docena (12) o un millar (1000). Un mol equivale a aproximadamente 6,022045 x 1023 partículas. Por ejemplo, 12 gramos de carbono o 1 gramo de hidrógeno contienen aproximadamente un mol de átomos. Este valor se conoce como el número de Avogadro, en honor al químico y físico italiano Carlo Amedeo Avogadro.
Dentro de los átomos, los electrones son muy importantes para las propiedades y reacciones químicas.
De los átomos a las moléculas
Los enlaces son las uniones entre átomos que forman moléculas. Una molécula es más estable que los átomos por separado. La diferencia de energía entre estos dos estados se llama energía de enlace.
Los átomos se combinan en proporciones fijas para crear moléculas específicas. Por ejemplo, dos átomos de hidrógeno se unen con uno de oxígeno para formar una molécula de agua. Esta proporción fija se llama estequiometría. Sin embargo, el mismo número y tipo de átomos pueden combinarse de diferentes maneras, dando lugar a sustancias isómeras (con la misma fórmula pero diferente estructura).
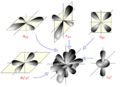
¿Qué son los orbitales?
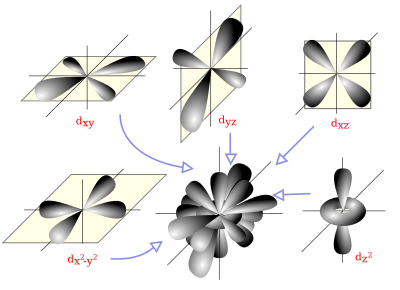
Para entender bien las reacciones químicas y las propiedades de las sustancias, es útil usar la idea de orbitales con la ayuda de la química cuántica.
Un orbital atómico es una función matemática que describe dónde es más probable encontrar uno o dos electrones en un átomo. Un orbital molecular es lo mismo, pero para las moléculas.
En la teoría del orbital molecular, los enlaces covalentes se forman cuando los orbitales atómicos se combinan matemáticamente para crear orbitales moleculares. Estos orbitales moleculares pertenecen a toda la molécula, no solo a un átomo. Al igual que un orbital atómico, un orbital molecular tiene un tamaño, una forma y una energía específicos.
¿Qué son las disoluciones?
En agua y otros disolventes (como la acetona o el alcohol), se pueden disolver sustancias. Esto significa que las sustancias se separan en sus moléculas o iones y se mezclan de forma uniforme (las disoluciones son transparentes). Cuando se añade demasiada sustancia y ya no se disuelve, se alcanza el límite de solubilidad. La sustancia extra puede quedar como precipitado en el fondo o como suspensión (pequeñas partículas flotando que hacen que la mezcla sea opaca o translúcida).
La concentración es una medida de la cantidad de soluto (la sustancia disuelta) en una cantidad determinada de disolvente o de la disolución total.
¿Cómo se mide la concentración?
La concentración de una disolución se puede expresar de varias maneras, dependiendo de las unidades que se usen:
- g/l: gramos de soluto por litro de disolución.
- % p/p: porcentaje de peso de soluto en el peso total de la disolución.
- % V/V: porcentaje de volumen de soluto en el volumen total de la disolución.
- M (molaridad): moles de soluto por litro de disolución.
- N (normalidad): equivalente de soluto por litro de disolución.
- m (molalidad): moles de soluto por kilogramo de disolvente.
- x (fracción molar): relación de moles de soluto respecto al total de moles.
- ppm (partes por millón): partes de soluto por millón de partes de disolución.
¿Qué es la acidez (pH)?
El pH es una escala que nos dice qué tan ácida o básica es una disolución acuosa (una mezcla con agua).
- Los ácidos, como el zumo de limón o el vinagre, tienen un pH bajo (menos de 7).
- Las bases, como la sosa o el bicarbonato de sodio, tienen un pH alto (más de 7).
- Una solución neutra (como el agua pura) tiene un pH de 7.
El pH se calcula con una fórmula matemática que mide la cantidad de iones hidrógeno en la solución.
- Si el pH es 7, la concentración de iones hidrógeno es 10-7 M.
- Si el pH es menor de 7 (ácido), la concentración de iones hidrógeno es mayor que 10-7 M.
- Si el pH es mayor de 7 (básico), la concentración de iones hidrógeno es menor que 10-7 M.
¿Cómo se nombran las sustancias químicas?
La IUPAC (Unión Internacional de Química Pura y Aplicada) es la organización que establece las reglas para la formulación y nomenclatura química de los compuestos. Esto permite que los químicos de todo el mundo se refieran a las sustancias de forma clara y sin confusiones.
Las fórmulas químicas también se usan para escribir las reacciones químicas en forma de ecuación química. Por ejemplo:
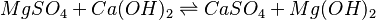
Galería de imágenes
-
Soluciones y sustancias en botellas de reactivos, incluyendo ácido nítrico e hidróxido de amonio, iluminados de diferentes colores
-
Tabla periódica de los elementos químicos moderna actualizada a 2016 por la IUPAC.
-
Ilustración de un laboratorio químico del siglo XVIII
-
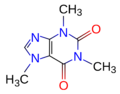
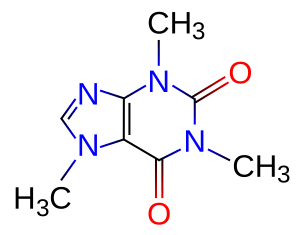
Fórmula estructural de la molécula de cafeína.
-
Instituto de Tecnología Química Inorgánica e Ingeniería Ambiental, Instituto de Polímeros e Instituto de Tecnología Química Orgánica, Universidad Tecnológica de Pomerania Occidental, en Szczecin, Polonia.
-
Diagrama espacial que muestra los orbitales atómicos hidrogenoides de momento angular del tipo d (l=2).
Véase también
 En inglés: Chemistry Facts for Kids
En inglés: Chemistry Facts for Kids
- Absorción
- Biología
- Catalizador
- Dinámica molecular
- Farmacia
- Filosofía de la química
- Física
- IUPAC
- Lista de compuestos
- Matemáticas
- Propiedades periódicas
- Química (etimología)
- Sustancia química
- Tabla periódica de los elementos
- Comparación de la química y la física
- Partícula Subátomica