Ley de Boyle-Mariotte para niños
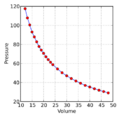
La ley de Boyle-Mariotte, o simplemente ley de Boyle, es una de las leyes de los gases. Esta ley nos ayuda a entender cómo se comportan los gases. Relaciona el volumen y la presión de una cantidad específica de gas cuando su temperatura se mantiene constante.
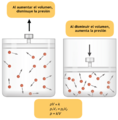
En palabras sencillas, la ley de Boyle dice que si tienes una cantidad de gas y no cambias su temperatura, la presión y el volumen del gas se comportan de forma opuesta. Si la presión aumenta, el volumen disminuye. Y si la presión disminuye, el volumen aumenta.
Imagina que tienes un globo. Si lo aprietas (aumentas la presión), su tamaño se hace más pequeño (el volumen disminuye). Si lo sueltas (disminuyes la presión), el globo vuelve a su tamaño normal (el volumen aumenta). Esto ocurre siempre que la temperatura del aire dentro del globo no cambie.
Contenido
Ley de Boyle: La Relación entre Presión y Volumen
La ley de Boyle es fundamental para entender cómo se comportan los gases en muchas situaciones. Fue descubierta por dos científicos de forma independiente.
¿Qué Dice la Ley de Boyle?
La ley de Boyle establece que la presión de una cantidad fija de gas es inversamente proporcional a su volumen, siempre que la temperatura se mantenga igual. Esto significa que si multiplicas la presión (P) por el volumen (V) de un gas, el resultado siempre será el mismo número, una constante (k).
- Si la presión sube, el volumen baja.
- Si la presión baja, el volumen sube.
Por ejemplo, si el volumen de un gas se reduce a la mitad, su presión se duplica. Y si el volumen se duplica, la presión se reduce a la mitad.
¿Cómo se Expresa Matemáticamente?
La ley de Boyle se puede escribir con una fórmula sencilla:
Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): P \cdot V = k
Donde:
- P es la presión del gas.
- V es el volumen del gas.
- k es una constante. Este número no cambia si la temperatura y la cantidad de gas son las mismas.
Cuando comparamos el mismo gas en dos situaciones diferentes (por ejemplo, antes y después de un cambio), podemos usar esta fórmula:
Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): P_1 \cdot V_1 = P_2 \cdot V_2
Aquí, P1 y V1 son la presión y el volumen iniciales, y P2 y V2 son la presión y el volumen finales.
La Historia Detrás de la Ley
La relación entre la presión y el volumen de un gas fue observada por primera vez en el siglo XVII por los científicos Richard Towneley y Henry Power.
El Trabajo de Robert Boyle
El científico irlandés Robert Boyle (en 1662) fue quien confirmó esta relación con muchos experimentos. Él publicó sus resultados, lo que hizo que la ley llevara su nombre. Se cree que su asistente, Robert Hooke, ayudó a construir los aparatos para los experimentos.
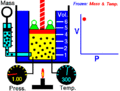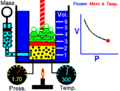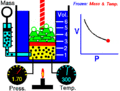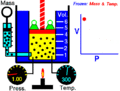
Boyle usó un tubo de vidrio en forma de "J" que estaba cerrado por un lado. Vertió mercurio en el tubo, lo que hizo que el aire atrapado en el lado cerrado se comprimiera. Al cambiar la cantidad de mercurio, Boyle pudo medir cómo cambiaban la presión y el volumen del aire. Descubrió que, si la temperatura era constante, la presión y el volumen siempre estaban relacionados de forma inversa.
La Contribución de Edme Mariotte
El físico francés Edme Mariotte (en 1676) descubrió la misma ley de forma independiente. Sin embargo, Boyle ya la había publicado antes. Mariotte también notó algo importante: el volumen del aire cambia con la temperatura. Por eso, a veces esta ley se llama ley de Boyle-Mariotte.
Más tarde, en 1687, Isaac Newton demostró matemáticamente esta relación, aunque la explicación física completa llegó mucho después con las teorías de James Clerk Maxwell y Ludwig Boltzmann.
¿Para Qué Sirve la Ley de Boyle?
La ley de Boyle nos ayuda a entender muchos fenómenos en la vida real y en la ciencia.
La Respiración Humana
Un ejemplo muy claro de la ley de Boyle es cómo funciona nuestra respiración.
- Cuando inhalamos, los músculos de nuestro cuerpo hacen que el volumen de nuestros pulmones aumente. Según la ley de Boyle, si el volumen de los pulmones aumenta, la presión del aire dentro de ellos disminuye.
- Como la presión dentro de los pulmones es ahora menor que la presión del aire exterior, el aire de afuera entra a nuestros pulmones.
- Cuando exhalamos, los músculos hacen que el volumen de los pulmones disminuya. Esto aumenta la presión del aire dentro de ellos.
- Como la presión dentro de los pulmones es ahora mayor que la presión del aire exterior, el aire sale de nuestros pulmones.
Así, la ley de Boyle explica cómo el aire entra y sale de nuestro cuerpo.
Conceptos Clave de la Ley de Boyle
Para entender mejor la ley, aquí están los símbolos que se usan:
| Símbolo | Nombre | Unidad |
|---|---|---|
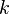 |
Constante | Pa m3 |
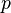 |
Presión | Pa (Pascal) |
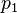 |
Presión inicial | Pa |
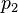 |
Presión final | Pa |
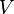 |
Volumen | m3 (metro cúbico) |
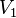 |
Volumen inicial | m3 |
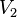 |
Volumen final | m3 |
Experimentos que Demuestran la Ley
Tanto Boyle como Mariotte realizaron experimentos para probar esta ley.
El Experimento del Tubo en J
En el experimento de Boyle, se usaba un tubo en forma de J. Al añadir mercurio, se aumentaba la presión sobre el aire atrapado. Se observó que a medida que se añadía más mercurio (aumentando la presión), el volumen del aire atrapado disminuía. Y al quitar mercurio (disminuyendo la presión), el volumen aumentaba. El producto de la presión por el volumen siempre era el mismo.
El Experimento de Mariotte
Mariotte también hizo un experimento similar. Usó un cilindro con un émbolo (una especie de tapa que se puede mover). Al empujar el émbolo, el volumen del gas disminuía y la presión aumentaba. Aquí tienes una tabla con resultados parecidos a los que él pudo haber obtenido:
| Experimento | Presión (atm) | Volumen (L) | Presión · Volumen |
|---|---|---|---|
| 1 | 0,5 | 60 | 30 |
| 2 | 1,0 | 30 | 30 |
| 3 | 1,5 | 20 | 30 |
| 4 | 2,0 | 15 | 30 |
| 5 | 2,5 | 12 | 30 |
| 6 | 3,0 | 10 | 30 |
Como puedes ver en la tabla, cuando la presión aumenta (de 0.5 a 3.0 atm), el volumen disminuye (de 60 a 10 L). Pero si multiplicas la presión por el volumen en cada caso, el resultado siempre es 30. Esto demuestra que el producto de la presión y el volumen es constante cuando la temperatura no cambia.
La ley de Boyle es una parte importante de las leyes de los gases, que nos ayudan a entender cómo se comportan los gases. Junto con la ley de Charles, la ley de Gay-Lussac y la ley de Avogadro, forma la base de la ley de los gases ideales.
Galería de imágenes
Véase también
 En inglés: Boyle's law Facts for Kids
En inglés: Boyle's law Facts for Kids
- Ley de los gases ideales
- Ley de Charles
- Ley de Gay-Lussac
- Ley general de los gases
- Ley de Avogadro
- Ley de Graham
- Gas ideal