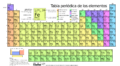Tabla periódica de los elementos para niños
La tabla periódica de los elementos es una forma especial de organizar todos los elementos químicos que conocemos. Imagina una gran tabla donde cada elemento tiene su propio lugar. Están ordenados por su número atómico (que es la cantidad de protones en su átomo), por cómo están distribuidos sus electrones y por sus propiedades químicas.
Este orden nos ayuda a ver patrones. Por ejemplo, los elementos que se comportan de manera similar se encuentran en la misma columna. Es como si la tabla periódica fuera el corazón de la química, tan importante como la teoría de la evolución en biología o los principios de la termodinámica en la física.
La tabla periódica tiene siete filas, llamadas períodos, y dieciocho columnas, llamadas grupos. Algunos grupos tienen nombres especiales, como el grupo 17, que son los halógenos, o el grupo 18, que son los gases nobles. La tabla también se divide en cuatro bloques con propiedades químicas parecidas.
Gracias a este orden, podemos entender cómo se relacionan las propiedades de los elementos. Incluso podemos predecir cómo serán elementos nuevos que aún no se han descubierto. La tabla periódica es una herramienta muy útil para estudiar el comportamiento de las sustancias y se usa mucho en química y otras ciencias.
Dmitri Mendeléyev publicó la primera versión de la tabla periódica en 1869. Él la creó para mostrar cómo las propiedades de los elementos conocidos en ese momento seguían un patrón. Otro científico, Julius Lothar Meyer, también hizo un trabajo similar, pero Mendeléyev fue el primero en predecir las propiedades de elementos que aún no se habían encontrado. ¡Y la mayoría de sus predicciones resultaron ser correctas!
Desde entonces, la tabla periódica de Mendeléyev ha crecido y mejorado. Se han descubierto o creado nuevos elementos, y hemos desarrollado nuevas ideas para entender cómo se comportan. La forma actual de la tabla fue diseñada por Alfred Werner basándose en la idea de Mendeléyev. Hay otras formas de tablas periódicas, que se usan para diferentes propósitos, como enseñar o estudiar geología. Para celebrar los 150 años de su creación, la Unesco declaró 2019 como el Año Internacional de la Tabla Periódica de los Elementos Químicos.
Hoy en día, conocemos todos los elementos desde el número 1 (hidrógeno) hasta el 118 (oganesón). La Unión Internacional de Química Pura y Aplicada (IUPAC) confirmó los elementos 113, 115, 117 y 118 en 2015, y sus nombres oficiales se anunciaron en 2016. Los primeros 94 elementos existen de forma natural, aunque algunos son muy raros. Los elementos del 95 al 118 solo se han creado en laboratorios. Los científicos siguen buscando y creando nuevos elementos con números atómicos aún más altos.
| Grupo | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| Bloque | s | d | p | |||||||||||||||
| ↓Período | ·El helio pertenece al bloque s | |||||||||||||||||
| 1 | 1 H |
2 He· |
||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne |
||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar |
||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr |
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe |
| 6 | 55 Cs |
56 Ba |
57-71 * |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn |
| 7 | 87 Fr |
88 Ra |
89-103 ** |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og |
| 8 | 119 Uue |
|||||||||||||||||
| Bloque | f | d | |||||||||||||||
| * | Lantánidos | 57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu |
|
| ** | Actínidos | 89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr |
|
| Leyenda | Estado de agregación de la materia a 0°C y 1 atm (Según el color del número atómico) |
||||
| 1 H |
<- Número atómico | Rojo | Azul | Negro | Gris |
| <- Símbolo químico | Gaseoso | Líquido | Sólido | Desconocido | |
| Metales | Metaloides | No metales | |||||||
| Alcalinos | Alcalino- térreos |
Lantánidos | Metales de transición |
Otros metales |
Otros no metales |
Halógenos | Gases nobles |
||
| Actínidos | |||||||||
Para una versión más detallada de la tabla periódica con hipertexto, consúltese Anexo:Tabla periódica.
Contenido
Historia de la tabla periódica
La historia de la tabla periódica está conectada con varios descubrimientos importantes en física y química.
- El descubrimiento de los elementos químicos que forman la tabla.
- El estudio de las propiedades de los elementos y cómo clasificarlos.
- La idea de la masa atómica (antes llamada "peso atómico") y, más tarde, el número másico.
- Las relaciones entre la masa atómica (y luego el número atómico) y las propiedades de los elementos.
Descubrimiento de los elementos
Algunos elementos como el oro (Au), la plata (Ag) o el cobre (Cu) se conocen desde hace mucho tiempo. El primer elemento descubierto de forma científica fue el fósforo (P) en el siglo XVII por Hennig Brand. En el siglo XVIII, se descubrieron muchos gases importantes como el oxígeno (O), el hidrógeno (H) y el nitrógeno (N).
Antoine Lavoisier hizo una lista de 33 elementos. A principios del siglo XIX, se descubrieron más elementos, como los metales alcalinos, gracias a los trabajos de Humphry Davy. En 1830, ya se conocían 55 elementos. A mediados del siglo XIX, con la invención del espectroscopio, se descubrieron nuevos elementos como el cesio (Cs) y el rubidio (Rb). Durante el siglo XX, la investigación sobre la radiactividad llevó al descubrimiento de muchos elementos pesados, la mayoría creados en laboratorios. En noviembre de 2016, la IUPAC aceptó oficialmente 118 elementos.
La idea de elemento y sus propiedades
Para poder crear la tabla periódica, primero se necesitaba descubrir suficientes elementos y entender sus propiedades. A lo largo de los siglos, se aprendió mucho sobre ellos.
La palabra "elemento" viene de la ciencia griega, pero su significado moderno apareció en el siglo XVII. Robert Boyle describió los elementos como "cuerpos primitivos y simples" que no están hechos de otras cosas y que son los ingredientes básicos de todo.
En el siglo XVIII, Antoine Lavoisier ayudó a diferenciar qué sustancias eran elementos químicos, cuáles eran sus propiedades y cómo aislarlas. Al descubrir tantos elementos nuevos y estudiar sus propiedades, los científicos notaron que algunos eran muy parecidos. Esto hizo que quisieran encontrar una forma de clasificarlos.
Los pesos atómicos
A principios del siglo XIX, John Dalton desarrolló una nueva idea sobre los átomos. Él propuso que cada elemento tiene átomos con una masa específica. Dalton usó la masa del átomo de hidrógeno como referencia y calculó las masas de otros átomos en comparación.
Por ejemplo, Dalton sabía que una parte de hidrógeno se combinaba con siete partes de oxígeno para formar agua. Si el agua se formaba uniendo un átomo de hidrógeno con uno de oxígeno, entonces la masa del át átomo de oxígeno debía ser siete veces la del hidrógeno. Así creó la primera tabla de masas atómicas relativas. Estas ideas fueron muy importantes, aunque al principio hubo algunas diferencias en los cálculos.
Primeros intentos de organizar los elementos
En 1789, Antoine Lavoisier publicó una lista de 33 elementos, agrupándolos en gases, metales, no metales y tierras. Aunque fue útil, esta clasificación no era perfecta porque había muchas diferencias entre los elementos de cada grupo.
Los químicos buscaron una forma más precisa de clasificar los elementos. Uno de los primeros fue el alemán Johann Wolfgang Döbereiner en 1817. Él notó que algunos grupos de tres elementos, llamados "tríadas", tenían propiedades muy parecidas. Por ejemplo, el cloro, el bromo y el yodo formaban una tríada. También descubrió que el peso atómico del elemento del medio era casi el promedio de los pesos de los otros dos. Esto se conoció como la Ley de las Tríadas.
Leopold Gmelin y Jean-Baptiste Dumas continuaron trabajando en este sistema. Aunque lograron identificar relaciones en grupos pequeños, aún no había un sistema que incluyera a todos los elementos.
En 1857, August Kekulé observó que el carbono a menudo se une a otros cuatro átomos, como en el metano. Esta idea se llamó "valencia".
En 1862, el geólogo francés Alexandre-Emile Béguyer de Chancourtois publicó una tabla periódica en forma de espiral, llamada "hélice telúrica". Fue el primero en notar que las propiedades de los elementos se repetían a intervalos regulares cuando se ordenaban por peso atómico. Sin embargo, su trabajo no fue muy conocido al principio.
En 1864, Julius Lothar Meyer publicó una tabla con 44 elementos ordenados por valencia. Mostró que los elementos con propiedades similares a menudo tenían la misma valencia. Al mismo tiempo, William Odling publicó un arreglo de 57 elementos por peso atómico, notando también la periodicidad.
La Ley de las Octavas de Newlands
El químico inglés John Newlands publicó varios trabajos entre 1863 y 1866. Él notó que cuando los elementos se ordenaban por su peso atómico creciente, las propiedades similares se repetían cada ocho elementos.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
|---|---|---|---|---|---|---|
| Li 6.9 Na 23.0 K 39.0 |
Be 9.0 Mg 24.3 Ca 40.0 |
B 10.8 Al 27.0 |
C 12.0 Si 28.1 |
N 14.0 P 31.0 |
O 16.0 S 32.1 |
F 19.0 Cl 35.5 |
Newlands comparó esta repetición con las octavas de la música. Su "Ley de las Octavas" fue criticada al principio porque no funcionaba para todos los elementos. Sin embargo, Newlands pudo usar su tabla para predecir la existencia de elementos que faltaban, como el germanio. Años después, la importancia de sus descubrimientos fue reconocida.
En 1867, Gustavus Hinrichs publicó un sistema periódico en espiral, pero fue considerado demasiado complicado.
La tabla periódica de Mendeléyev
En 1869, el profesor ruso Dmitri Mendeléyev publicó su primera tabla periódica. Un año después, Julius Lothar Meyer publicó una versión ampliada de su propia tabla. En ese momento, ya se conocían 63 de los 92 elementos que existen de forma natural.
Ambos científicos ordenaron los elementos por su masa atómica creciente. Los agruparon en filas (períodos) y columnas (grupos) de elementos con propiedades químicas similares, como la valencia.
La tabla de Mendeléyev fue muy aceptada por dos razones importantes. Primero, dejó espacios vacíos para elementos que aún no se habían descubierto. Usó las tendencias de su tabla para predecir las propiedades de esos elementos faltantes. Por ejemplo, predijo el galio (al que llamó eka-aluminio) y el germanio (eka-silicio).
La segunda razón fue que, a veces, Mendeléyev ignoró el orden de los pesos atómicos y cambió elementos de lugar, como el telurio y el yodo, para que encajaran mejor con sus familias químicas. En 1913, Henry Moseley descubrió el número atómico de cada elemento y demostró que el orden de Mendeléyev coincidía con el aumento del número atómico.
El significado de estos números en la tabla periódica no se entendió completamente hasta que se descubrieron los protones y los neutrones. Las tablas de Mendeléyev usaban el peso atómico, que era lo que se podía medir con precisión en ese momento. Moseley predijo que solo faltaban unos pocos elementos entre el aluminio (Z = 13) y el oro (Z = 79), y estos fueron descubiertos más tarde. El orden por número atómico se sigue usando hoy en día.
Desarrollos posteriores de la tabla periódica
En 1871, Mendeléyev publicó una nueva versión de su tabla, con los grupos de elementos similares en columnas. También hizo predicciones más detalladas de los elementos que faltaban. Estas "lagunas" se llenaron a medida que se descubrían nuevos elementos.
Su nueva tabla organizaba las columnas según los hidruros y óxidos que podían formar los elementos, lo que mostraba sus valencias. Aunque todavía tenía algunas inconsistencias, fue un gran avance. Más tarde, se añadió un grupo para los gases nobles, que se descubrieron después y no encajaban en la tabla original.
El francio, que Mendeléyev llamó eka-cesio, se descubrió en 1939. El plutonio, creado en 1940, también se encontró en pequeñas cantidades en la naturaleza en 1971.
La forma estándar de la tabla periódica que usamos hoy se atribuye a Horace Groves Deming, un químico estadounidense que la publicó en 1923. Se hizo muy popular en las escuelas de Estados Unidos.
Mecánica cuántica y la expansión de la tabla
La tabla periódica de Mendeléyev tenía algunos desafíos. Con el tiempo, hubo que añadir los gases nobles, las "tierras raras" y los elementos radioactivos. Otro problema era que a veces el orden por peso atómico no coincidía con la agrupación por propiedades químicas. Por ejemplo, el telurio y el yodo estaban cambiados de lugar.
Esta cuestión se resolvió cuando Henry Moseley estudió los espectros de rayos X en 1913. Moseley descubrió que el orden de los elementos en la tabla no era casual, sino que reflejaba una propiedad de la estructura atómica: el número atómico (Z), que es la cantidad de protones en el núcleo.
La explicación actual de la ley periódica surgió con el desarrollo de la mecánica cuántica en el siglo XX. Gracias a estas investigaciones, sabemos que el orden de los elementos en la tabla periódica está relacionado con cómo se organizan los electrones en sus átomos. Esto nos permite predecir sus propiedades químicas.
En 1945, Glenn Seaborg sugirió que los actínidos (una serie de elementos) se llenaban de una manera diferente a lo que se pensaba. Sus colegas le aconsejaron no publicar una idea tan "radical", pero él lo hizo de todos modos. Resultó que tenía razón, y en 1951 ganó el Premio Nobel de Química por su trabajo.
En 1952, el científico costarricense Gil Chaverri presentó una nueva versión de la tabla basada en la estructura electrónica de los elementos, que ubicaba a los lantánidos y actínidos de forma más lógica.
Aunque algunos elementos transuránicos (más allá del uranio) existen en la naturaleza en cantidades muy pequeñas, la mayoría fueron descubiertos por primera vez en laboratorios. El primero fue el neptunio, sintetizado en 1939. La creación de estos elementos ha expandido mucho la tabla periódica. Como muchos son muy inestables, es difícil detectarlos.
El 30 de diciembre de 2015, la IUPAC reconoció oficialmente los elementos 113, 115, 117 y 118, completando la séptima fila de la tabla periódica. El 28 de noviembre de 2016, se anunciaron sus nombres y símbolos oficiales: Nh (nihonio), Mc (moscovio), Ts (teneso) y Og (oganesón).
Estructura y organización de la tabla periódica
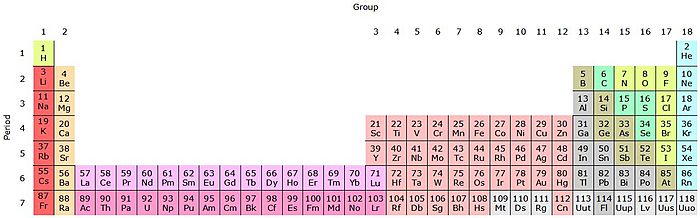
La tabla periódica actual es un sistema donde se clasifican los elementos conocidos. Se colocan de izquierda a derecha y de arriba abajo, siguiendo el orden creciente de sus números atómicos. Los elementos se organizan en siete filas horizontales, llamadas períodos, y en 18 columnas verticales, llamadas grupos o familias.
En la tabla, el tamaño de los átomos (radio atómico y radio iónico) aumenta hacia abajo y hacia la izquierda. La energía necesaria para quitar un electrón (energía de ionización), la capacidad de un átomo para atraer electrones (afinidad electrónica) y la fuerza con la que un átomo atrae electrones en un enlace (electronegatividad) aumentan hacia arriba y hacia la derecha.
Grupos de elementos
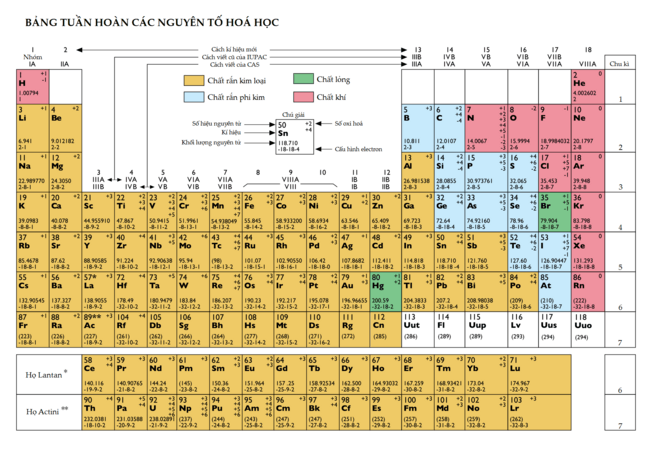
Las columnas verticales de la tabla se llaman grupos o familias. Hay dieciocho grupos en la tabla periódica estándar. Se numeran del uno al dieciocho, desde la columna de la izquierda (los metales alcalinos) hasta la de la derecha (los gases nobles).
Antes, se usaban números romanos y letras para nombrar los grupos. Por ejemplo, el grupo 4 era IVB y el grupo 14 era IVA. En 1988, se adoptó el sistema actual de la nomenclatura IUPAC.
Algunos grupos tienen nombres comunes, aunque no siempre se usan. Los grupos del 3 al 10 no tienen nombres especiales y se les llama por su número o por el nombre de su primer elemento (por ejemplo, "el grupo del escandio"). Esto es porque no siempre muestran tantas similitudes verticales.
La razón moderna para el orden de la tabla periódica es que los elementos de un mismo grupo tienen configuraciones electrónicas similares. Esto significa que tienen la misma cantidad de electrones en su capa más externa, lo que se conoce como valencia. Como las propiedades químicas dependen mucho de estos electrones externos, los elementos de un mismo grupo tienen propiedades químicas parecidas y muestran una tendencia clara a medida que aumenta el número atómico.
Por ejemplo, los elementos del grupo 1 tienen un solo electrón externo y tienden a perderlo para formar iones positivos. Los elementos del último grupo, los gases nobles, tienen su capa externa llena. Por eso, son muy poco reactivos y se les llama "gases inertes".
Los elementos de un mismo grupo también muestran patrones en su radio atómico, energía de ionización y electronegatividad. Al bajar en un grupo, el tamaño de los átomos aumenta porque tienen más capas de electrones. Esto hace que sea más fácil quitar un electrón, por lo que la energía de ionización disminuye. La electronegatividad también disminuye al bajar en un grupo.
Hay algunas excepciones a estas tendencias, especialmente en los bloques d y f, donde las similitudes horizontales pueden ser tan importantes como las verticales.
Períodos de elementos
Las filas horizontales de la tabla periódica se llaman períodos. El número de capas de energía de un átomo determina a qué período pertenece. Cada capa se divide en subniveles, que se llenan en un orden específico a medida que aumenta el número atómico.
|
Siguiendo esta regla, cada elemento se coloca según su configuración electrónica, lo que da forma a la tabla periódica.
Los elementos en el mismo período muestran tendencias similares en radio atómico, energía de ionización, afinidad electrónica y electronegatividad. En un período, el tamaño del átomo generalmente disminuye de izquierda a derecha. Esto se debe a que cada elemento sucesivo tiene más protones y electrones, lo que hace que los electrones sean atraídos más cerca del núcleo. Esta disminución del radio atómico también hace que la energía de ionización y la electronegatividad aumenten de izquierda a derecha. La afinidad electrónica también muestra una tendencia similar. Los metales (a la izquierda) suelen tener una afinidad menor que los no metales (a la derecha), excepto los gases nobles.
La tabla periódica tiene siete períodos:
Bloques de la tabla periódica
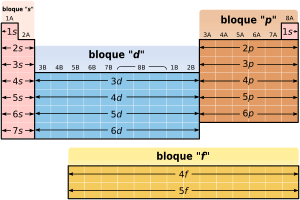
La tabla periódica también se puede dividir en bloques, según cómo se llenan las capas de electrones de los elementos. Cada bloque se nombra según el orbital donde se encuentra el último electrón: s, p, d y f.
- El bloque s incluye los dos primeros grupos (metales alcalinos y alcalinotérreos), además del hidrógeno y el helio.
- El bloque p incluye los últimos seis grupos (del 13 al 18) y contiene, entre otros, todos los metaloides.
- El bloque d incluye los grupos del 3 al 12 y contiene todos los metales de transición.
- El bloque f, que a menudo se coloca debajo del resto de la tabla, no tiene números de grupo y está formado por los lantánidos y actínidos.
Podría haber más elementos que llenarían otros orbitales, pero aún no se han descubierto. Si se descubrieran, se seguiría el orden alfabético para nombrarlos, como el bloque g hipotético.
Metales, metaloides y no metales
Según sus propiedades físicas y químicas, los elementos se clasifican en tres grandes categorías: metales, metaloides y no metales.
- Los metales suelen ser sólidos brillantes, buenos conductores de electricidad y calor. Forman aleaciones entre sí y compuestos con no metales.
- La mayoría de los no metales son gases incoloros o de colores. Pueden formar enlaces con otros no metales.
- Entre los metales y no metales están los metaloides, que tienen propiedades intermedias.
Los metales y no metales se pueden dividir en subcategorías que muestran un cambio gradual de propiedades. Por ejemplo, los metales alcalinos son muy reactivos, mientras que los metales alcalinotérreos son menos reactivos. Los no metales se subdividen en no metales poliatómicos, no metales diatómicos y los gases nobles, que son muy poco reactivos.
La clasificación de los elementos en estas categorías no es perfecta. Hay un rango de propiedades dentro de cada categoría, y a veces un elemento puede tener características de más de una. Por ejemplo, el berilio es un metal alcalinotérreo, pero también tiene algunas propiedades de metal de transición. El radón es un gas noble, pero también tiene algunas características de metal.
Otras formas de representar la tabla periódica
Variantes del grupo 3
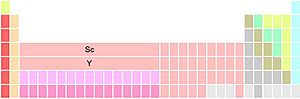
Hay tres formas principales de organizar el grupo 3 de la tabla periódica. El escandio y el itrio siempre están en este grupo, pero las diferencias están en los otros dos elementos que lo completan.
- El grupo 3 está formado por Sc, Y, La y Ac. El lantano (La) y el actinio (Ac) se colocan debajo del itrio (Y). Esta es la forma más común. Destaca las similitudes en las tendencias periódicas de los grupos 1, 2 y 3, pero puede causar algunas interrupciones en las tendencias entre los grupos 3 y 4.
- El grupo 3 está formado por Sc, Y, Lu y Lr. El lutecio (Lu) y el lawrencio (Lr) se colocan debajo del itrio. Esta variante mantiene el bloque f con 14 columnas y ayuda a que los lantánidos y actínidos no estén separados.
- El grupo 3 está formado por Sc, Y, y 15 lantánidos y 15 actínidos. Las dos posiciones debajo del itrio contienen todos los lantánidos y actínidos. Esta variante resalta las similitudes químicas de los 15 elementos lantánidos, pero puede ser un poco confusa sobre qué elementos ocupan exactamente esas dos posiciones.
Estas variantes surgen de las dificultades históricas para colocar los lantánidos en la tabla periódica. Algunos dicen que esto demuestra que es un error dividir el sistema en bloques tan definidos.
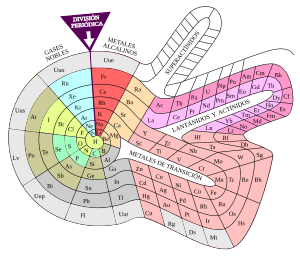
Tablas periódicas con estructura diferente
La tabla periódica moderna a veces se muestra en una forma más larga, con 32 columnas. En esta versión, los elementos del bloque f se colocan en su posición natural entre los bloques s y d. A diferencia de la forma de 18 columnas, esta disposición muestra un aumento continuo en los números atómicos. También hace más fácil ver la relación del bloque f con los otros bloques. Algunos expertos creen que esta forma es mejor para que los estudiantes entiendan los lantánidos y actínidos. Sin embargo, los libros suelen usar la forma de 18 columnas porque es más fácil de imprimir en una página.
Los científicos discuten cuál es el mejor modelo de tabla periódica. Muchos se preguntan si la forma bidimensional es la más adecuada. Argumentan que se basa en la comodidad de ajustarla a una página de libro. El propio Mendeléyev no estaba del todo satisfecho y consideró una distribución en espiral. Algunos argumentos para nuevos modelos incluyen la ubicación de los lantánidos y actínidos fuera del cuerpo principal de la tabla. Incluso se ha sugerido que el helio debería estar en el grupo dos, ya que comparte dos electrones en su capa externa con los alcalinotérreos.
Por estas razones, a lo largo de los años se han desarrollado otras tablas periódicas con diferentes formas, como triángulos, pirámides, escalones, torres y espirales. Ejemplos de espirales son la "galaxia química" de Phillip Stewart y la espiral de Theodor Benfey. Se calcula que se han publicado más de setecientas versiones de la tabla periódica.
Phillip Stewart cree que si Mendeléyev hubiera seguido desarrollando el modelo en espiral, habría podido predecir las propiedades de los halógenos. Basándose en esta idea, Stewart creó su propia tabla periódica en espiral, la "Galaxia química", donde la longitud creciente de los períodos se acomoda en los brazos de una galaxia.
Theodor Benfey pensaba que la tabla periódica estándar no mostraba bien la idea de periodicidad.
Por eso, diseñó una tabla periódica ovalada, similar a un campo de fútbol, que no tenía saltos ni elementos "flotantes". Ordenó los elementos en una espiral continua, con el hidrógeno en el centro. Sin embargo, no estaba satisfecho con el espacio para los lantánidos. Así que, en un rediseño de 1964, añadió una protuberancia para ellos. La espiral de Benfey se hizo popular y se usó en calendarios y libros de texto.
La tabla fractal se basa en la idea de que las características de un elemento al final de una fila continúan con el inicio de la siguiente. Esto sugiere que la tabla podría representarse mejor como un cilindro. Además, esta tabla incorpora a los actínidos y lantánidos en su lugar correcto por número atómico, en lugar de mantenerlos separados. El resultado es que las familias siguen arcos radiales en lugar de columnas.
La mayoría de las tablas periódicas son bidimensionales, pero también existen tablas en tres dimensiones desde 1862. Algunos ejemplos recientes son la Clasificación Periódica de Courtines (1925) y la hélice periódica de Paul-Antoine Giguère (1965).
Las diferentes formas de tablas periódicas se pueden ver como un continuo. Algunas, como la Tabla Periódica Inorgánica de Rayner-Canham (2002), se enfocan en las tendencias y propiedades químicas. Otras, como la tabla periódica ampliada escalonada por la izquierda de Charles Janet (1928), muestran una relación más cercana con cómo se llenan los electrones en las capas y con la mecánica cuántica. La tabla periódica estándar se considera un buen equilibrio, ya que muestra las tendencias de las propiedades físicas, la conductividad y otras características que se pueden observar fácilmente en el laboratorio.
Elementos y sus estados
Aquí te mostramos algunos elementos y su estado en condiciones normales de presión y temperatura (0 °C y 1 atmósfera).
Gases
| Elemento | Símbolo | Grupo | Período | Átomo | Masa | Protones | Neutrones | Electrones |
|---|---|---|---|---|---|---|---|---|
| Hidrógeno | H | 1 | 1 | 1 | 1 | 1 | 0 | 1 |
| Nitrógeno | N | 15 | 2 | 7 | 14 | 7 | 7 | 7 |
| Oxígeno | O | 16 | 2 | 8 | 16 | 8 | 8 | 8 |
| Flúor | F | 17 | 2 | 9 | 19 | 9 | 10 | 9 |
| Cloro | Cl | 17 | 3 | 17 | 35 | 17 | 19 | 17 |
| Helio | He | 18 | 1 | 2 | 4 | 2 | 2 | 2 |
| Neón | Ne | 18 | 2 | 10 | 20 | 10 | 10 | 10 |
| Argón | Ar | 18 | 3 | 18 | 40 | 18 | 22 | 18 |
| Kriptón | Kr | 18 | 4 | 36 | 84 | 36 | 48 | 36 |
| Xenón | Xe | 18 | 5 | 54 | 131 | 54 | 77 | 54 |
| Radón | Rn | 18 | 6 | 86 | 222 | 86 | 136 | 86 |
Líquidos
| Elemento | Símbolo | Grupo | Período | Átomo | Masa | Protones | Neutrones | Electrones |
|---|---|---|---|---|---|---|---|---|
| Cesio | Cs | 1 | 6 | 55 | 133 | 55 | 78 | 55 |
| Francio | Fr | 1 | 7 | 87 | 223 | 87 | 136 | 87 |
| Mercurio | Hg | 12 | 6 | 80 | 201 | 80 | 121 | 80 |
| Galio | Ga | 13 | 4 | 31 | 70 | 31 | 39 | 31 |
| Bromo | Br | 17 | 4 | 35 | 80 | 35 | 45 | 35 |
Elementos de transición
| Elemento | Símbolo | Grupo | Período | Átomo | Masa | Protones | Neutrones | Electrones |
|---|---|---|---|---|---|---|---|---|
| Rutherfordio | Rf | 4 | 7 | 104 | 261 | 104 | 157 | 104 |
| Dubnio | Db | 5 | 7 | 105 | 262 | 105 | 157 | 105 |
| Seaborgio | Sg | 6 | 7 | 106 | 263 | 106 | 157 | 106 |
| Tecnecio | Tc | 7 | 5 | 43 | 99 | 43 | 56 | 43 |
| Bohrio | Bh | 7 | 7 | 107 | 262 | 107 | 155 | 107 |
| Hassio | Hs | 8 | 7 | 108 | 265 | 108 | 157 | 108 |
| Meitnerio | Mt | 9 | 7 | 109 | 266 | 109 | 157 | 109 |
| Darmstadtio | Ds | 10 | 7 | 110 | 271 | 110 | 161 | 110 |
| Roentgenio | Rg | 11 | 7 | 111 | 272 | 111 | 161 | 111 |
| Copernicio | Cn | 12 | 7 | 112 | 272 | 112 | 160 | 112 |
| Nihonio | Nh | 13 | 7 | 113 | 283 | 113 | 170 | 113 |
| Flerovio | Fl | 14 | 7 | 114 | 285 | 114 | 171 | 114 |
| Moscovio | Mc | 15 | 7 | 115 | 288 | 115 | 173 | 115 |
| Livermorio | Lv | 16 | 7 | 116 | 289 | 116 | 173 | 116 |
| Teneso | Ts | 17 | 7 | 117 | 291 | 117 | 174 | 117 |
| Oganesón | Og | 18 | 7 | 118 | 293 | 118 | 175 | 118 |
Elementos lantánidos y actínidos
| Elemento | Símbolo | Grupo | Período | Átomo | Masa | Protones | Neutrones | Electrones |
|---|---|---|---|---|---|---|---|---|
| Prometio | Pm | Lantánido | (-) | 61 | 147 | 61 | 86 | 61 |
| Neptunio | Np | Actínido | (-) | 93 | 237 | 93 | 144 | 93 |
| Plutonio | Pu | Actínido | (-) | 94 | 244 | 94 | 150 | 94 |
| Americio | Am | Actínido | (-) | 95 | 243 | 95 | 148 | 95 |
| Curio | Cm | Actínido | (-) | 96 | 247 | 96 | 151 | 96 |
| Berkelio | Bk | Actínido | (-) | 97 | 247 | 97 | 150 | 97 |
| Californio | Cf | Actínido | (-) | 98 | 251 | 98 | 153 | 98 |
| Einstenio | Es | Actínido | (-) | 99 | 252 | 99 | 153 | 99 |
| Fermio | Fm | Actínido | (-) | 100 | 257 | 100 | 157 | 100 |
| Mendelevio | Md | Actínido | (-) | 101 | 258 | 101 | 157 | 101 |
| Nobelio | No | Actínido | (-) | 102 | 259 | 102 | 157 | 102 |
| Laurencio | Lr | Actínido | (-) | 103 | 262 | 103 | 159 | 103 |
Sólidos alcalinos y alcalinotérreos
| Elemento | Símbolo | Grupo | Período | Átomo | Masa | Protones | Neutrones | Electrones |
|---|---|---|---|---|---|---|---|---|
| Litio | Li | Alcalino | 2 | 3 | 7 | 3 | 4 | 3 |
| Sodio | Na | Alcalino | 3 | 11 | 23 | 11 | 12 | 11 |
| Potasio | K | Alcalino | 4 | 19 | 39 | 19 | 20 | 19 |
| Rubidio | Rb | Alcalino | 5 | 37 | 86 | 37 | 49 | 37 |
| Berilio | Be | Alcalinotérreo | 2 | 4 | 9 | 4 | 5 | 4 |
| Magnesio | Mg | Alcalinotérreo | 3 | 12 | 24 | 12 | 12 | 12 |
| Calcio | Ca | Alcalinotérreo | 4 | 20 | 40 | 20 | 20 | 20 |
| Estroncio | Sr | Alcalinotérreo | 5 | 38 | 88 | 38 | 50 | 38 |
| Bario | Ba | Alcalinotérreo | 6 | 56 | 137 | 56 | 81 | 56 |
| Radio | Ra | Alcalinotérreo | 7 | 88 | 226 | 88 | 138 | 88 |
Sólidos de las familias del escandio, titanio, vanadio y cobre
| Elemento | Símbolo | Grupo | Período | Átomo | Masa | Protones | Neutrones | Electrones |
|---|---|---|---|---|---|---|---|---|
| Escandio | Sc | Escandio | 4 | 21 | 45 | 21 | 24 | 21 |
| Itrio | Y | Escandio | 5 | 39 | 89 | 39 | 50 | 39 |
| Lantano | La | Escandio | 6 | 57 | 139 | 57 | 82 | 57 |
| Actinio | Ac | Escandio | 7 | 89 | 227 | 89 | 138 | 89 |
| Titanio | Ti | Titanio | 4 | 22 | 48 | 22 | 26 | 22 |
| Circonio | Zr | Titanio | 5 | 40 | 91 | 40 | 51 | 40 |
| Hafnio | Hf | Titanio | 6 | 72 | 179 | 72 | 105 | 72 |
| Vanadio | V | Vanadio | 4 | 23 | 50 | 23 | 27 | 23 |
| Niobio | Nb | Vanadio | 5 | 41 | 93 | 41 | 52 | 41 |
| Tantalio | Ta | Vanadio | 6 | 73 | 181 | 73 | 108 | 73 |
| Cobre | Cu | Cobre | 4 | 29 | 64 | 29 | 35 | 29 |
| Plata | Ag | Cobre | 5 | 47 | 107 | 47 | 61 | 47 |
| Oro | Au | Cobre | 6 | 79 | 196 | 79 | 118 | 79 |
Galería de imágenes
Ver también
- Alternativas de tablas periódicas
- Tabla periódica de los elementos ampliada
- Tabla periódica ampliada escalonada por la izquierda
- Tabla periódica de Miguel Catalán
- La tabla periódica de Dmitri Mendeléyev
- Nomenclatura química de los compuestos inorgánicos (para consultar los números de valencia de los elementos)
- Anexo:Elementos químicos por símbolo
- Anexo:Elementos químicos por orden alfabético
- Abundancia de los elementos químicos
- Nombres de los elementos
- Descubrimiento de los elementos químicos
- Anexo:Controversias sobre la denominación de los elementos
Véase también
 En inglés: Periodic table Facts for Kids
En inglés: Periodic table Facts for Kids