Mol para niños
Datos para niños Mol |
||
|---|---|---|
| Estándar | Unidades básicas del Sistema Internacional | |
| Magnitud | Cantidad de sustancia | |
| Símbolo | mol | |
| Equivalencias | ||
| Cantidad: | 1 mol = 6,022 140 76 × 1023 unidades elementales | |
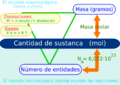
El mol (símbolo: mol) es una unidad de medida muy importante en la química. Se usa para contar una cantidad muy grande de partículas diminutas, como átomos o moléculas, que son los bloques de construcción de todo lo que nos rodea. Es una de las siete unidades básicas del Sistema Internacional de Unidades, como el metro para la longitud o el segundo para el tiempo.
Contenido
¿Qué es el Mol y por qué es importante?
El mol nos ayuda a medir la "cantidad de sustancia". Imagina que quieres contar granos de arena en una playa. Sería imposible contarlos uno por uno. De la misma manera, los átomos y las moléculas son tan pequeños y hay tantos en cualquier material, que necesitamos una forma especial de contarlos. El mol es esa forma.
Un mol de cualquier sustancia contiene exactamente 6,022 140 76 × 1023 partículas. Este número gigantesco se llama número de Avogadro. Las partículas pueden ser átomos, moléculas, iones, electrones o cualquier otra partícula muy pequeña que estemos estudiando.
¿Cómo nos ayuda el mol en la química?
El concepto de mol es clave en la química porque nos permite hacer cálculos muy importantes. Por ejemplo, en las reacciones químicas, el mol nos indica la proporción exacta en que las sustancias se combinan o se forman.
Por ejemplo, para formar agua (H2O), se necesitan dos moléculas de hidrógeno (H2) y una molécula de oxígeno (O2). En términos de moles, esto significa que dos moles de hidrógeno reaccionan con un mol de oxígeno para formar dos moles de agua. Esto es muy útil para los científicos.
También se usa el mol para medir la concentración de una sustancia en una disolución, lo que se conoce como molaridad. Además, nos ayuda a calcular la masa molar, que es la masa de un mol de una sustancia en gramos.
El volumen de los gases y el mol
Un dato interesante es que, bajo las mismas condiciones de temperatura y presión, un mol de cualquier gas ocupa el mismo volumen. Esto se debe a que los gases se comportan de manera similar a nivel de partículas.
Se ha descubierto que un mol de cualquier gas ocupa aproximadamente 22,4 litros en condiciones normales de temperatura y presión. A este volumen se le llama volumen molar del gas.
Historia del Mol: ¿De dónde viene este concepto?
Dado que las partículas son tan diminutas y numerosas, los científicos buscaron formas de medirlas sin tener que contarlas individualmente.
Los primeros pasos para contar partículas
Uno de los primeros en intentar cuantificar las moléculas fue Joseph Loschmidt en el siglo XIX. Los químicos de esa época usaban métodos basados en el peso para comparar cantidades de sustancias. Así surgieron términos como "átomo-gramo" o "molécula-gramo", que hoy han sido reemplazados por el mol.
Amadeo Avogadro y su gran idea
El concepto del mol está muy ligado al científico italiano Amadeo Avogadro, quien nació en 1776. Aunque estudió leyes, su verdadera pasión era la ciencia.
Avogadro se inspiró en la ley de Gay-Lussac, que describe cómo los gases se expanden con el calor. Él propuso una idea revolucionaria en 1811: si tienes volúmenes iguales de gases diferentes, a la misma temperatura y presión, estos contienen el mismo número de partículas. Esta idea fue un gran avance para entender cómo se comportan los gases.
Al principio, la idea de Avogadro no fue muy aceptada, pero con el tiempo, las pruebas científicas la confirmaron. Investigaciones posteriores permitieron calcular el número exacto de partículas en un mol, lo que hoy conocemos como el número de Avogadro.
El término "mol" y su definición moderna
El término "mol" fue introducido por el químico Wilhelm Ostwald en 1886. La palabra viene del latín Mole, que significa "pila" o "montón", lo cual tiene sentido, ya que un mol es un "montón" de partículas.
Finalmente, en 1971, el mol fue oficialmente definido como una de las siete unidades fundamentales del Sistema Internacional de Unidades. En 2018, la definición se actualizó para basarse directamente en el valor fijo del número de Avogadro, lo que la hace aún más precisa.
Aclaraciones importantes sobre el Mol
Es importante recordar que un mol se refiere al número de partículas, no a su tamaño o peso. Piensa en una docena: una docena de huevos es la misma cantidad que una docena de sandías, aunque las sandías sean mucho más grandes y pesadas. De la misma manera, un mol de átomos de hidrógeno tiene la misma cantidad de átomos que un mol de átomos de plomo, aunque los átomos de plomo sean mucho más grandes y pesados.
- Un mol de moléculas de hidrógeno (H2) pesa 2 gramos. Esto significa que un mol de átomos de hidrógeno (H) pesa 1 gramo.
- Para evitar confusiones, es bueno especificar si hablamos de moles de átomos o de moléculas. Por ejemplo, "un mol de moléculas de nitrógeno" (N2) pesa 28 gramos.
- El concepto de mol también se aplica a partículas sin masa, como los fotones.
- Incluso en compuestos iónicos, como la sal de mesa (NaCl), donde no hay moléculas individuales, se usa el mol. Un mol de NaCl (58,5 gramos) contiene el número de Avogadro de iones de sodio (Na+) y el número de Avogadro de iones de cloro (Cl-).
Ejemplo con la molécula de agua (H2O)
Para entenderlo mejor, veamos el ejemplo del agua:
- Una molécula de agua (H2O) tiene dos átomos de hidrógeno y un átomo de oxígeno.
- Su masa molecular relativa es 18 (2x1 para H + 16 para O).
- La masa molar del agua es 18 gramos por mol. Esto significa que 1 mol de agua pesa 18 gramos.
- En un mol de agua, hay 6,02214076 × 1023 moléculas de H2O.
- También, en un mol de agua, hay 2 moles de átomos de hidrógeno y 1 mol de átomos de oxígeno.
Equivalencias clave del Mol
- Cantidad de partículas: 1 mol de cualquier sustancia equivale a 6,02214076 × 1023 unidades elementales (el número de Avogadro).
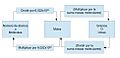
- Masa molar: La masa de un mol de una sustancia (su masa molar) es igual a su masa atómica o molecular, pero expresada en gramos.
- Volumen de gases: 1 mol de un gas ideal ocupa 22,4 litros a 0 °C y 1 atmósfera de presión.
- Cálculo de moles: Para saber cuántos moles (n) hay en una cantidad de sustancia con masa (m), se usa la fórmula:
n = m / Mr Donde Mr es la masa molar relativa de la sustancia.
Galería de imágenes
Véase también
 En inglés: Mole (unit) Facts for Kids
En inglés: Mole (unit) Facts for Kids