Precipitado para niños
La precipitación es un proceso químico donde se forma un sólido a partir de una solución líquida. Imagina que tienes agua con sal disuelta; si la sal se vuelve visible y se asienta en el fondo, eso es precipitación. El sólido que se forma se llama precipitado. La sustancia que ayuda a que se forme este sólido se llama 'precipitante'.
Si el precipitado es muy ligero, puede quedarse flotando en la solución. Pero con la ayuda de la gravedad (un proceso llamado sedimentación) o usando una máquina especial como una centrifugadora, el sólido se asienta y se compacta, formando lo que a veces se llama "gránulo". El líquido que queda por encima del sólido se conoce como "sobrenadante".
A veces, la aparición de un precipitado nos indica que ha ocurrido una reacción química. Por ejemplo:
- Si mezclas una solución de nitrato de plata con una de cloruro de sodio, verás un precipitado blanco de cloruro de plata.
- Si combinas una solución de yoduro de potasio con una de nitrato de plomo (II), se formará un precipitado amarillo de yoduro de plomo (II).
La precipitación puede ocurrir cuando la cantidad de una sustancia en una solución es mayor de lo que puede disolver. Esto puede pasar al mezclar diferentes líquidos o al cambiar la temperatura. También puede ocurrir rápidamente en una solución que está "sobresaturada", es decir, que tiene más sustancia disuelta de lo normal.
En algunos materiales sólidos, la precipitación sucede si la concentración de un sólido supera su límite de disolución dentro de otro sólido. Esto puede ser por un enfriamiento rápido o por la adición de iones. Este proceso se usa para crear estructuras muy pequeñas llamadas nanoclústeres.
Un paso clave en la precipitación es la nucleación. Es el momento en que las primeras partículas sólidas comienzan a formarse. Para que esto ocurra, se necesita energía para crear la superficie del nuevo sólido. Si no hay suficiente energía o una superficie adecuada para que empiece la formación, la solución puede volverse sobresaturada.
Contenido
Usos de la precipitación
Las reacciones de precipitación tienen muchas aplicaciones útiles en la vida diaria y en la industria.
Fabricación de productos
Se pueden usar para fabricar pigmentos (los materiales que dan color a las pinturas), o para eliminar sales del agua en el tratamiento de aguas. También son importantes en el análisis químico para identificar sustancias.
Aislamiento y purificación
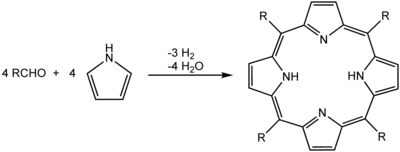
La precipitación es muy útil para separar productos de una reacción química. Lo ideal es que el producto que queremos obtener no se disuelva en el líquido de la reacción. Así, cuando se forma, se precipita y podemos recogerlo fácilmente, a menudo en forma de cristales puros. Un ejemplo es la fabricación de porfirinas, que al enfriarse la mezcla, se precipitan como cristales y se pueden filtrar.
También se puede provocar la precipitación añadiendo un "antidisolvente". Este es un líquido en el que el producto deseado no se disuelve, lo que hace que se precipite. Después, el precipitado se puede separar fácilmente usando un filtro, dejando que se asiente (decantación) o con una centrifugadora. Por ejemplo, para purificar el ADN, se le añade etanol para que precipite.
Fortalecimiento de materiales
En la metalurgia, que es el estudio de los metales, la precipitación de una solución sólida es una forma importante de hacer que las aleaciones (mezclas de metales) sean más fuertes. Este proceso se conoce como fortalecimiento por solución sólida.
Precipitación en la salud
En el campo de la inmunología, las reacciones de precipitación son sencillas de realizar y observar. Ocurren cuando un antígeno (una sustancia que el cuerpo reconoce como extraña) reacciona con un anticuerpo (una proteína que el cuerpo produce para defenderse). El antígeno se llama 'precipitógeno' y el anticuerpo 'precipitina'. Estas reacciones se usan en los laboratorios para el diagnóstico de algunas enfermedades, como en la prueba de VDRL o en la inmunodifusión doble de Ouchterlony.
Precipitación para limpiar el agua
La precipitación química es una técnica común para limpiar el agua. Consiste en añadir sustancias (reactivos) que transforman los contaminantes disueltos en formas que no se disuelven o que se disuelven muy poco. Así, estos contaminantes se vuelven sólidos y se pueden eliminar del agua.
Por ejemplo, se pueden quitar los bicarbonatos del agua añadiendo hidróxido de calcio. Esto forma carbonato de calcio, que es poco soluble y se asienta como un polvo fino.
Esta tecnología es muy usada para reducir la concentración de metales en el agua residual. Metales como el plomo, el mercurio, el cobre o el cadmio pueden eliminarse añadiendo hidróxido de sodio o de calcio, lo que hace que se precipiten como hidróxidos. También se usa para "ablandar" el agua, es decir, para eliminar la dureza del agua.
Cómo se representan las reacciones de precipitación
Las reacciones de precipitación se pueden escribir usando ecuaciones químicas. Por ejemplo, cuando el nitrato de plata acuoso (AgNO3) se mezcla con cloruro de potasio (KCl), se forma un sólido blanco de cloruro de plata (AgCl).
- <chem>AgNO3 + KCl -> AgCl (v) + KNO3</chem>
Aquí, el AgCl es el precipitado, indicado con la flecha hacia abajo (v).
También podemos escribir esta reacción mostrando los iones que se separan en la solución. Esto se llama ecuación iónica:
- <chem>Ag+ + NO3^- + K+ + Cl^- -> AgCl (v) + K+ + NO3^-</chem>
Y una forma más simple es la ecuación iónica neta, que solo muestra los iones que realmente participan en la formación del precipitado:
- <chem>Ag+ + Cl^- -> AgCl (v)</chem>
Colores de los precipitados
Muchos compuestos que contienen iones de metales forman precipitados con colores específicos. Aquí tienes algunos ejemplos de colores típicos:
| Oro | Negro |
| Cromo | Verde oscuro, verde turbio, naranja, violeta, amarillo, marrón |
| Cobalto | Rosado |
| Cobre | Azul |
| Hierro (II) | Verde |
| Hierro (III) | Marrón rojizo |
| Manganeso | Rosa pálido |
| Níquel | Verde |
| Plomo | Amarillo |
Otros compuestos suelen formar precipitados de color blanco.
Identificación de sustancias
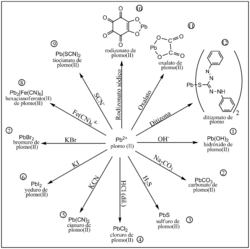
La formación de precipitados es muy útil para identificar el tipo de catión (un ion con carga positiva) en una sal desconocida. Para hacerlo, se hace reaccionar la sal con una base, lo que produce un precipitado que es el hidróxido de la sal. Observando el color del precipitado y si se disuelve o no en exceso de la base, se puede identificar el catión. Por ejemplo, si una solución de nitrato de bario reacciona con iones de sulfato y forma un precipitado de sulfato de bario sólido, esto indica que probablemente hay iones de sulfato presentes.
Maduración del precipitado
La maduración, o "envejecimiento del precipitado", ocurre cuando un precipitado recién formado se deja reposar en la solución de la que se formó, a menudo a una temperatura más alta. Esto hace que las partículas del precipitado se vuelvan más limpias y más grandes. El proceso detrás de esto se llama maduración de Ostwald.
Galería de imágenes
-
Al mezclar una solución de sulfato cúprico (CuSO4) con una de hidróxido sódico (NaOH), se forma sulfato de sodio (Na2SO4) e hidróxido de cobre (II) (Cu(OH)2), que al ser insoluble se precipita.
Véase también
 En inglés: Chemical precipitation Facts for Kids
En inglés: Chemical precipitation Facts for Kids