Química supramolecular para niños
La química supramolecular es una parte de la química que estudia cómo las moléculas se unen entre sí de formas especiales, sin formar enlaces químicos fuertes como los que las mantienen unidas por dentro. Imagina que las moléculas son como piezas de un rompecabezas que se juntan para crear estructuras más grandes y complejas.
Esta área de la química se inspira mucho en la biología, donde las moléculas de los seres vivos se organizan de maneras increíbles para funcionar. Se basa en lo que ya sabemos de la química orgánica (la química del carbono) y la inorgánica (la química de otros elementos).
La química supramolecular nos ayuda a entender cómo las moléculas se "reconocen" entre sí y cómo forman "agregados supramoleculares". Esto es clave para comprender el mundo biológico, los sistemas complejos y la nanotecnología, que es la creación de cosas muy, muy pequeñas.
Jean-Marie Lehn, un científico muy importante, la definió como: "La química de los enlaces entre moléculas, que abarca las estructuras y funciones de las entidades formadas por la unión de dos o más tipos de sustancias químicas".
Los agregados supramoleculares que estudia esta química son muy variados. Pueden ser desde sistemas biológicos complejos, como las membrana plasmáticas o las enzimas, donde muchas moléculas se organizan solas para formar estructuras más grandes, hasta grupos de pocas moléculas que se "autoensamblan", como los catenanos o los rotaxanos.
Contenido
Historia de la química supramolecular
El concepto de química supramolecular fue explicado por primera vez en 1987 por el Premio Nobel Jean-Marie Lehn. Él la describió como "la química de los enlaces entre moléculas". Sin embargo, muchos trabajos anteriores sentaron las bases para que esta rama de la química se desarrollara.
En 1810, Humphry Davy demostró que el cloro era un elemento químico. Más tarde, en 1823, Michael Faraday continuó estudiando el cloro. En 1891, los científicos Villiers y Hebd descubrieron las ciclodextrinas, que son moléculas que pueden "guardar" a otras moléculas más pequeñas. Estos descubrimientos fueron importantes.
Una contribución clave fue la de Alfred Werner en 1893, quien introdujo el término "química de coordinación". Este concepto es fundamental para entender cómo funciona la química supramolecular.
En 1894, el Premio Nobel Hermann Emil Fischer propuso una idea muy importante: que las interacciones entre las enzimas y las sustancias sobre las que actúan son como una "cerradura y una llave". Esta idea es la base del reconocimiento molecular, donde una molécula encaja perfectamente con otra.
A principios del siglo XX, se entendieron mejor los enlaces débiles, como el puente de hidrógeno, descrito en 1920 por Latimer y Rodebush.
El conocimiento de estos principios ayudó a entender mejor la estructura de las proteínas y otros procesos biológicos. Por ejemplo, el gran avance que permitió descubrir la estructura de doble hélice del ADN fue entender que dos cadenas de nucleótidos se unen mediante puentes de hidrógeno. Estos enlaces débiles son esenciales para que el ADN se copie, ya que permiten que las cadenas se separen y sirvan de molde para nuevas cadenas. Al mismo tiempo, los químicos comenzaron a estudiar estructuras sintéticas basadas en estas interacciones débiles, como las micelas.
Con el tiempo, los químicos lograron aplicar estos conceptos a sistemas creados en laboratorio. Un gran avance ocurrió en la década de 1960 con la síntesis de los éteres corona por Charles J. Pedersen. Después de este trabajo, otros investigadores como Donald James Cram, Jean-Marie Lehn y Fritz Vögtle continuaron desarrollando esta química hasta la década de 1980, lo que les valió el Premio Nobel de Química en 1987.
Construcción "de abajo hacia arriba"
Los sistemas supramoleculares funcionan gracias a cómo se organizan sus partes. Se usan moléculas como si fueran pequeños bloques de construcción. De esta manera, se pueden crear moléculas complejas que luego se usarán para formar un sistema con propiedades especiales.
Una forma de crear sistemas complejos es usando el método "de abajo hacia arriba" (bottom-up). Este método ofrece muchas maneras de construir nanoestructuras, que son cosas extremadamente pequeñas. Sería muy difícil manipularlas de otra forma.
La naturaleza nos da ejemplos de cómo funciona este método, especialmente en los sistemas biológicos. Estos sistemas no usan enlaces químicos fuertes, por lo que su formación es muy eficiente. El objetivo es crear nanoestructuras sintéticas que imiten a los sistemas biológicos, para que puedan reconocer y unirse a otras moléculas de forma precisa.
Reconocimiento molecular
El reconocimiento molecular explica cómo una molécula se une de forma específica a otra, como si tuviera una "cerradura" para una "llave" particular. Las moléculas que logran este reconocimiento eficiente y selectivo se llaman moléculas anfitrionas (host).
Estas moléculas anfitrionas suelen ser compuestos cíclicos llamados macrociclos. Tienen cavidades de tamaños específicos en su interior, perfectas para albergar a otras moléculas más pequeñas, llamadas huéspedes (guest).
Este reconocimiento molecular es clave en los procesos donde se usan catalizadores, ya sean naturales como las enzimas o sintéticos. Estos catalizadores forman complejos supramoleculares con las sustancias sobre las que actúan (sustratos) en tres pasos:
- Reconocimiento: El catalizador y el sustrato se reconocen y forman un complejo. Esto define qué tan selectivo es el catalizador.
- Aceleración: La reacción se acelera y se necesita menos energía para que ocurra.
- Regeneración: El catalizador se recupera y libera el producto, listo para iniciar un nuevo ciclo.
Un concepto que explica muy bien el reconocimiento molecular es el modelo de la llave-cerradura, propuesto en 1884 por el bioquímico alemán E. Fischer.
Autoensamblaje molecular
El autoensamblaje molecular es cuando las moléculas se organizan solas para formar estructuras más grandes y ordenadas.
Un ejemplo muy conocido de autoensamblaje en sistemas biológicos es la replicación del ADN. La estructura de doble hélice del ADN se mantiene unida por puentes de hidrógeno. En el ADN, cuatro tipos de moléculas (Guanina, Citosina, Adenina y Timina) se unen de dos en dos: la Guanina (G) siempre se une con la Citosina (C) formando tres puentes de hidrógeno, y la Adenina (A) siempre se une con la Tiamina (T) formando dos puentes de hidrógeno. Estas uniones crean las interacciones entre las dos hélices del ADN.
En esta estructura, la unión depende de la afinidad de las moléculas para formar los puentes de hidrógeno. Es muy difícil que se cometan errores en la formación del ADN, lo que hace que este proceso sea muy eficiente y rápido.
Metalosupramolecular
En la química metalosupramolecular, se usan compuestos que combinan una parte orgánica con un ion o un metal. Esto permite crear nanoestructuras con propiedades especiales. La forma de estas estructuras puede cambiar mucho según cómo se sinteticen, lo que afecta cómo interactúan con otras moléculas.
Estas estructuras suelen ser polígonos en dos dimensiones. El tamaño y el ángulo en que los componentes se conectan hacen que el sistema sea ideal para las moléculas que tienen afinidad con él. Así, la selección de moléculas que pueden unirse es muy específica.
Rejillas
Las rejillas supramoleculares son estructuras donde varios componentes se organizan en filas paralelas, y otras series de iones metálicos se cruzan con ellas, formando una red. Esta red crece a medida que se añaden más iones.
Entropía de formación
Cuando se crean nanoestructuras, es importante considerar la entropía de formación. Esto se refiere a la energía relacionada con el desorden o la libertad de movimiento de las moléculas. Es clave para que las estructuras sean estables y se organicen correctamente.
Entropía de traslación
La entropía de traslación mide cuántas formas diferentes puede tener una molécula de moverse en un espacio. En líquidos o gases, las moléculas tienen más libertad de movimiento, por lo que su entropía de traslación es mayor.
Entropía rotacional
La entropía rotacional se relaciona con la capacidad de una molécula para girar. La forma en que una molécula gira en una solución afecta cómo se une a otros componentes.
Entropía vibracional
La frecuencia de las vibraciones de una molécula puede influir en cómo se unen otras moléculas a ella. Algunas moléculas necesitan vibraciones específicas para unirse correctamente. Las vibraciones pueden aumentar la entropía y, en algunos casos, favorecer la unión o agregación de moléculas.
Interacciones supramoleculares
Las interacciones supramoleculares nos ayudan a entender cómo las moléculas se mantienen unidas mediante fuerzas débiles, llamadas interacciones no covalentes. Estas fuerzas son mucho más débiles que los enlaces químicos que forman las moléculas, pero son esenciales para que las estructuras supramoleculares funcionen. Algunas de las interacciones no covalentes más importantes son:
- Iónicas: Ocurren cuando dos moléculas con cargas opuestas (una positiva y otra negativa) se atraen. No dependen de una dirección específica. La estabilidad de esta interacción puede verse afectada por el medio en el que se encuentran.
- Ion-dipolo: Se dan entre una molécula cargada y una molécula neutra que tiene un lado positivo y otro negativo (un dipolo). La molécula neutra se orienta para que su lado opuesto a la carga se acerque a la molécula cargada.
- Dipolares:
- Dipolo-dipolo: Suceden entre dos moléculas que tienen dipolos (un lado positivo y otro negativo). Estas moléculas se alinean para que sus lados opuestos se atraigan. Son comunes en moléculas neutras que tienen grupos como carbonilos (C=O) o aminas.
- De Van Der Waals: Son interacciones débiles que surgen de las fluctuaciones en la distribución de los electrones entre moléculas cercanas. Cuanto más fácil sea para una molécula cambiar la distribución de sus electrones (más polarizable), más fuertes serán estas interacciones.
- Interacción de Keersom: Ocurre entre moléculas que tienen dipolos permanentes y se atraen.
- Interacción de Debye: Una molécula con un dipolo permanente induce un dipolo en otra molécula cercana, atrayéndola.
- Interacción de London: Se da entre dos moléculas que no tienen dipolos permanentes, pero que pueden formar dipolos temporales debido al movimiento de sus electrones.
- Interacciones π-π de apilamiento:
Estas interacciones son muy importantes en la química supramolecular, especialmente porque se observan en la forma en que se apilan las proteínas y en la estructura del ADN.
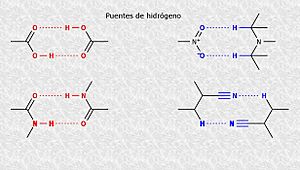
- Puente de hidrógeno: Esta interacción ocurre entre un átomo de hidrógeno que está unido a un átomo muy electronegativo (como oxígeno o nitrógeno) y otro átomo electronegativo de una molécula cercana. Los puentes de hidrógeno son más fuertes cuando están en línea recta, lo que los hace muy específicos para formar complejos organizados y estables. Sin embargo, son difíciles de formar en agua, ya que el agua también forma muchos puentes de hidrógeno.
Agregados supramoleculares importantes
- Cromatina
- Membrana plasmática
- Ribosoma
- Macrociclo
- Criptando
- Enzima
- Coloide
- Micela
- Ciclodextrina
- Liposoma
- Lipoproteína
- Ciclofano
- Podando
Véase también
 En inglés: Supramolecular chemistry Facts for Kids
En inglés: Supramolecular chemistry Facts for Kids
- Autoensamblaje molecular