Orbital molecular para niños
En el mundo de la química cuántica, los orbitales moleculares son como "mapas" que nos muestran dónde es más probable encontrar los electrones dentro de una molécula. Imagina que son regiones especiales en el espacio. Estos mapas se crean usando fórmulas matemáticas que describen cómo se mueven los electrones, que son partículas muy pequeñas con un comportamiento similar a las ondas.
Gracias a estas fórmulas, los científicos pueden calcular muchas cosas sobre las moléculas. Por ejemplo, pueden saber dónde es más probable que esté un electrón. La palabra orbital la usó por primera vez en inglés el científico Robert S. Mulliken en 1932. Él la tomó de una palabra alemana que usó Erwin Schrödinger en 1925.
Los orbitales moleculares se forman cuando los orbitales atómicos (que son los mapas de los electrones en átomos individuales) se unen. Esto se hace con un método llamado "combinación lineal". Hay formas de calcular estos orbitales de manera muy precisa usando métodos como el de Hartree-Fock.
Existen tres tipos principales de orbitales moleculares:
- Orbitales de enlace: Son como "pegamento" para la molécula. Tienen menos energía que los orbitales atómicos originales, lo que ayuda a que los átomos se mantengan unidos.
- Orbitales antienlazantes: Estos son lo contrario. Tienen más energía y, si los electrones los ocupan, pueden hacer que la molécula se separe.
- Orbitales no enlazantes: Tienen la misma energía que los orbitales atómicos de los que provienen. No ayudan ni impiden que la molécula se una.
Contenido
¿Qué es la configuración electrónica molecular?
Los orbitales moleculares son muy importantes para entender la configuración electrónica de las moléculas. Esto nos dice cómo se distribuyen los electrones en una molécula. Es como el "código postal" de cada electrón. A menudo, los orbitales moleculares se representan como una combinación de orbitales atómicos.
Una de las aplicaciones más útiles es que nos dan un modelo sencillo para entender cómo se forman los enlaces químicos en las moléculas. La mayoría de los cálculos en química cuántica empiezan por calcular estos orbitales. Un orbital molecular describe cómo se comporta un electrón bajo la influencia de los núcleos de los átomos y de los otros electrones.
Si dos electrones ocupan el mismo orbital, deben tener "espines" opuestos. Esto es una regla importante llamada principio de exclusión de Pauli.
Los orbitales moleculares suelen extenderse por toda la molécula. Si una molécula tiene simetría (como un espejo o una rotación), sus orbitales también la tendrán. Esto significa que los electrones no están fijos en un solo lugar, sino que se mueven por toda la molécula.
¿Cómo se obtienen los orbitales moleculares?
Para entender cómo se forman las moléculas, podemos imaginar que los orbitales moleculares se crean a partir de la combinación lineal de orbitales atómicos.
Aquí tienes algunas reglas sencillas para entender cómo se forman:
- El número de orbitales moleculares que se forman es igual al número de orbitales atómicos que se combinan.
- Los orbitales atómicos se mezclan mejor si tienen energías parecidas. Por ejemplo, en una molécula como el oxígeno (O2), los orbitales de cada átomo de oxígeno se mezclan mucho. Pero si los átomos son muy diferentes, como en el agua (H2O), los orbitales del oxígeno tendrán más influencia en el orbital molecular.
- Los orbitales atómicos solo se mezclan si sus formas y simetrías lo permiten. Los orbitales que no "encajan" bien no se combinarán. Las combinaciones más fuertes ocurren cuando los orbitales atómicos se superponen mucho.
Combinaciones lineales de orbitales atómicos (LCAO)
Los científicos Friedrich Hund y Robert S. Mulliken fueron los primeros en hablar de los orbitales moleculares en 1927 y 1928. La idea de la combinación lineal de orbitales atómicos (LCAO) la propuso Sir John Lennard-Jones en 1929. Él demostró cómo se podía entender la estructura de moléculas como el flúor y el oxígeno usando principios de la química cuántica. Este fue un gran paso para la química moderna.
Cuando los átomos se acercan, sus orbitales atómicos se superponen. Esto crea zonas donde los electrones se concentran, formando los orbitales moleculares. Los átomos se mantienen unidos porque los núcleos (con carga positiva) son atraídos por los electrones (con carga negativa) que están en los orbitales de enlace.
Tipos de orbitales moleculares: Enlace, Antienlace y No Enlace
Cuando los orbitales atómicos interactúan, el resultado puede ser uno de estos tres tipos de orbitales moleculares:
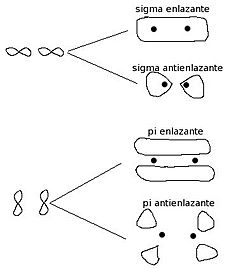
- Orbitales moleculares enlazantes:
- Se forman cuando los orbitales atómicos se unen de forma constructiva (como dos ondas que se suman).
- Tienen menos energía que los orbitales atómicos originales, lo que hace que la molécula sea más estable.
- Orbitales moleculares antienlazantes:
- Se forman cuando los orbitales atómicos se unen de forma destructiva (como dos ondas que se restan).
- Tienen una zona vacía (un "plano nodal") entre los dos átomos.
- Tienen más energía que los orbitales atómicos originales, lo que los hace menos estables.
- Orbitales no enlazantes:
- Se forman cuando los orbitales atómicos no interactúan entre sí, a menudo por falta de simetría.
- Tienen la misma energía que los orbitales atómicos de los que provienen.
El ejemplo de la molécula de hidrógeno
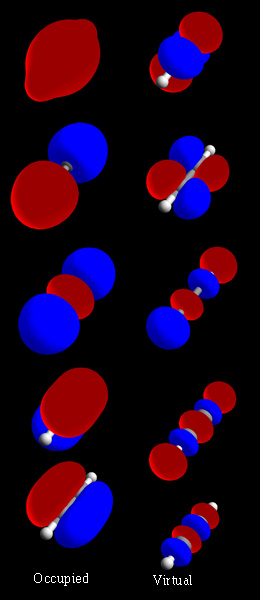
Para entenderlo mejor, veamos la molécula de dihidrógeno (H2). Tiene dos átomos de hidrógeno, H' y H". Sus orbitales atómicos más simples, 1s' y 1s", se pueden combinar de dos maneras:
| 1s' - 1s" | Esta es una combinación antisimétrica. |
| 1s' + 1s" | Esta es una combinación simétrica. |
La combinación simétrica (llamada orbital enlazante) tiene menos energía que los orbitales originales. La combinación antisimétrica (llamada orbital antienlazante) tiene más energía. Como la molécula de hidrógeno tiene dos electrones, ambos pueden ocupar el orbital enlazante. Esto hace que la molécula sea más estable que dos átomos de hidrógeno separados. A esto lo llamamos enlace covalente.
Tipos específicos de orbitales moleculares
Cuando dos orbitales atómicos se unen, forman diferentes tipos de orbitales moleculares:
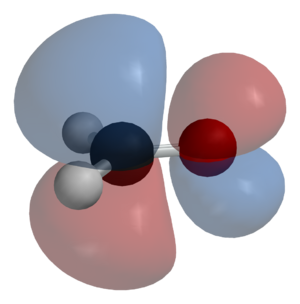
- Orbitales σ (sigma) enlazantes: Se forman por la combinación de orbitales atómicos "s" con "p" (s-s, p-p, s-p, p-s). Son enlaces "sencillos" y tienen una forma cilíndrica alrededor del eje que une los átomos.
- Orbitales π (pi) enlazantes: Se forman por la combinación de orbitales atómicos "p" que están perpendiculares al eje de enlace. Los electrones en estos orbitales se mueven por encima y por debajo del plano de enlace, como nubes.
- Orbitales σ* (sigma estrella) antienlazantes: Son la versión de mayor energía de los orbitales sigma enlazantes.
- Orbitales π* (pi estrella) antienlazantes: Son la versión de mayor energía de los orbitales pi enlazantes.
- Orbitales n (no enlazantes): Se encuentran en moléculas con átomos como el nitrógeno (N) o el oxígeno (O). Los electrones en estos orbitales no participan directamente en el enlace.
Los orbitales moleculares se "llenan" de electrones siguiendo algunas reglas, igual que los orbitales atómicos:
- Por orden de energía: Primero se llenan los orbitales de menor energía (los enlazantes) y luego los de mayor energía (los antienlazantes). La molécula siempre busca la situación más estable.
- Principio de exclusión de Pauli: Cada orbital molecular puede tener un máximo de dos electrones, y estos deben tener espines opuestos.
- Regla de máxima multiplicidad de Hund: Si hay varios orbitales con la misma energía, los electrones se distribuyen primero uno por uno en cada orbital (con el mismo espín) antes de empezar a emparejarse. Esto hace que la molécula sea más estable.
Siguiendo estas reglas, podemos entender por qué algunas moléculas son estables y otras no:
- Cuando se unen dos átomos de hidrógeno, sus orbitales 1s forman un orbital sigma enlazante (de menor energía) y un orbital sigma antienlazante (de mayor energía). Los dos electrones de los hidrógenos van al orbital sigma enlazante, haciendo que la molécula de H2 sea estable.
- Si intentamos unir dos átomos de helio (He), cada uno tiene dos electrones. Al unirse, formarían un orbital sigma enlazante y un sigma antienlazante. Los cuatro electrones llenarían ambos orbitales. Pero como los orbitales antienlazantes tienen mucha energía, la molécula de He2 sería inestable y no existe.
Más información
- Orbital
- Método de orbitales moleculares como una combinación lineal de orbitales atómicos
- Método Hückel
Véase también
 En inglés: Molecular orbital Facts for Kids
En inglés: Molecular orbital Facts for Kids