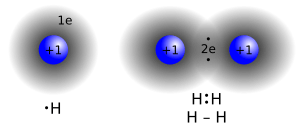Enlace covalente para niños
En química, un enlace covalente es un tipo de unión que se forma entre dos átomos no metálicos. Estos átomos se unen y comparten uno o más electrones de su última capa para volverse más estables. Es como si se dieran la mano y compartieran algo para que ambos estén completos.
Esta unión ocurre cuando la diferencia en la capacidad de los átomos para atraer electrones (llamada electronegatividad) no es muy grande. Si la diferencia fuera muy grande, un átomo le quitaría los electrones al otro, formando un enlace iónico. En el enlace covalente, los electrones se comparten en un nuevo espacio llamado orbital molecular.
Los enlaces covalentes pueden formarse entre átomos del mismo elemento no metálico (como dos átomos de oxígeno), entre diferentes no metales (como carbono y oxígeno), o entre un no metal y el hidrógeno.
Cuando átomos diferentes se unen de forma covalente, uno puede atraer los electrones compartidos un poco más que el otro. Esto crea una pequeña diferencia de carga, como si un lado fuera un poco más negativo y el otro un poco más positivo. A esto se le llama dipolo eléctrico. Si los átomos son iguales, no hay diferencia de atracción y no se forman dipolos.
En resumen, en un enlace iónico, los electrones se transfieren de un átomo a otro. En un enlace covalente, los electrones se comparten. Los átomos pueden compartir uno, dos o tres pares de electrones, formando enlaces simples, dobles o triples. En los dibujos de estructura de Lewis, estos enlaces se representan con líneas pequeñas entre los átomos.
Contenido
Historia del Enlace Covalente
La idea de la unión covalente se empezó a desarrollar hace mucho tiempo. En 1916, un científico llamado Gilbert N. Lewis describió cómo los átomos podían compartir pares de electrones. Él creó una forma de dibujar los átomos y sus electrones de la última capa, usando puntos alrededor del símbolo del átomo. A esto se le conoce como la estructura de Lewis o "notación de puntos de electrones". Cuando dos puntos (electrones) estaban entre dos átomos, significaba que se estaban compartiendo y formaban un enlace covalente.
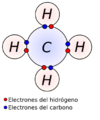
Lewis propuso que los átomos forman suficientes enlaces covalentes para completar su capa de electrones exterior. Por ejemplo, en una molécula de metano, el carbono comparte electrones con cuatro hidrógenos, y así todos los átomos alcanzan su estabilidad.
Más tarde, en 1919, otro científico llamado Irving Langmuir usó por primera vez la palabra "covalencia". Él explicó que la covalencia es el número de pares de electrones que un átomo comparte con los átomos que tiene cerca.
Tipos de Sustancias Covalentes
Existen dos tipos principales de sustancias que se forman con enlaces covalentes:
Sustancias Covalentes Moleculares
En este tipo, los enlaces covalentes forman moléculas individuales. Estas moléculas tienen las siguientes características:
- Se derriten y hierven a temperaturas bajas.
- A temperatura ambiente, pueden ser sólidos, líquidos o gases.
- Son blandas cuando están en estado sólido.
- No conducen la electricidad ni el calor.
- Su Solubilidad depende de su polaridad: las moléculas polares se disuelven en líquidos polares, y las no polares en líquidos no polares.
- Ejemplos: dióxido de carbono, benceno, oxígeno, nitrógeno.
Redes o Sustancias Covalentes Reticulares
Aquí, los átomos se unen con enlaces covalentes formando una red gigante y continua, como un cristal. Sus propiedades son diferentes:
- Necesitan temperaturas muy altas para derretirse y hervir.
- Siempre son sólidos a temperatura ambiente.
- Son sustancias muy duras.
- No conducen la electricidad (excepto el grafito).
- No se disuelven en casi nada.
- Ejemplos: cuarzo, diamante.
¿Cómo se forma un Enlace Covalente?
Imagina dos átomos de hidrógeno que se acercan. Cada uno tiene un electrón. A medida que se acercan, el núcleo positivo de un átomo atrae al electrón del otro átomo. Al mismo tiempo, los electrones se repelen entre sí. Llega un punto en que estas fuerzas se equilibran, y los átomos se unen de la forma más estable.
Lo que ocurre es que los espacios donde se mueven los electrones (llamados orbitales) se superponen. Así, los electrones se comparten y ya no se puede saber a qué átomo pertenece cada uno.
Cuando se forma una molécula de hidrógeno (H2), pasan varias cosas importantes:
- Las propiedades de los átomos de hidrógeno separados son muy diferentes a las de la molécula de H2. Por eso, siempre escribimos H2 para el hidrógeno gaseoso.
- Los dos núcleos positivos atraen a los dos electrones compartidos, haciendo que la molécula sea más estable que los átomos separados. Los electrones tienen más probabilidades de estar entre los dos núcleos.
- La distancia entre los núcleos es la ideal para que los orbitales se superpongan al máximo. En el caso del hidrógeno, esta distancia es de aproximadamente 0.74 Å. A esta distancia se le llama longitud de enlace.
- Se necesita mucha energía para romper los enlaces covalentes en el hidrógeno gaseoso y separar los átomos.
Polaridad en los Enlaces Covalentes
Cuando los átomos que se unen son diferentes, los electrones compartidos no son atraídos por igual. El átomo que tiene una mayor capacidad para atraer electrones (el más electronegativo) los jalará un poco más hacia sí. Esto crea una pequeña diferencia de carga en la molécula, llamada polaridad. El átomo más electronegativo tendrá una carga ligeramente negativa, y el otro una carga ligeramente positiva.
Si la diferencia de electronegatividad entre los átomos es muy pequeña (entre 0 y 0.4), el enlace se considera covalente no polar o puro. Si la diferencia es un poco mayor (entre 0.4 y 1.7), el enlace es covalente polar. Si la diferencia es muy grande (más de 1.7 o 2.0), el enlace ya no es covalente, sino enlace iónico.
Enlace Covalente Polar
En un enlace covalente polar, los electrones se comparten de forma desigual. Pasan más tiempo cerca del átomo más electronegativo. Esto hace que aparezcan cargas ligeramente positivas (δ+) y ligeramente negativas (δ–) en diferentes partes de la molécula.
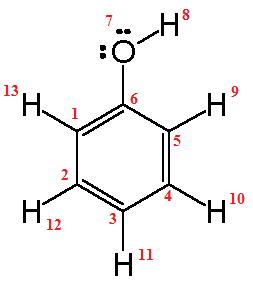
Un ejemplo claro es la molécula de agua. El oxígeno es mucho más electronegativo que el hidrógeno. Por eso, el oxígeno en el agua tiene una carga parcialmente negativa, y los hidrógenos tienen cargas parcialmente positivas.
Enlace Covalente No Polar
Los enlaces covalentes no polares se forman entre dos átomos del mismo elemento (donde la electronegatividad es la misma) o entre átomos de diferentes elementos que atraen los electrones de manera casi igual.
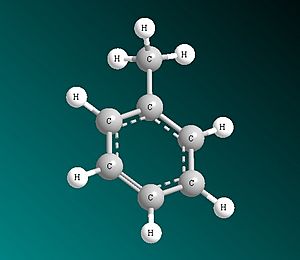
Por ejemplo, en una molécula de oxígeno (O2), los dos átomos de oxígeno comparten los electrones de forma equitativa, por lo que el enlace es no polar. Otro ejemplo es el metano (CH4). Aunque el carbono y el hidrógeno no tienen exactamente la misma electronegatividad, son muy parecidas, así que los enlaces carbono-hidrógeno se consideran no polares.
| Sustancias no polares | Sustancias polares |
|---|---|
| Etano | Metanol |
| Tolueno | Fenol |
| isobutano | Acetona |
| Pentano | Ácido propanoico |
Galería de imágenes
Véase también
 En inglés: Covalent bond Facts for Kids
En inglés: Covalent bond Facts for Kids