Concentración para niños
En química, la concentración de una disolución es la cantidad de una sustancia (llamada soluto) que está disuelta en otra sustancia (llamada disolvente). El resultado de esta mezcla es una disolución. Imagina que el soluto es el azúcar y el disolvente es el agua. Cuando los mezclas, obtienes una disolución de agua azucarada.
Si hay poco soluto disuelto en el disolvente, la disolución está poco concentrada. Si hay mucho soluto, la disolución está muy concentrada. Una disolución es una mezcla tan bien hecha que no puedes distinguir sus partes a simple vista.
La palabra "concentración" también se usa para hablar de un proceso. Este proceso busca aumentar la cantidad de soluto en el disolvente. Es lo contrario de la dilución, que es cuando añades más disolvente para que la disolución sea menos concentrada.
Contenido
¿Qué es la solubilidad?
Cada sustancia tiene un límite de cuánto puede disolverse en un disolvente. Este límite se llama solubilidad. La solubilidad es la cantidad máxima de soluto que puede disolverse en una disolución.
La solubilidad puede cambiar según la temperatura o la presión. Por ejemplo, si añades sal común a un vaso de agua y la mezclas, la sal se disolverá. Si sigues añadiendo sal, llegará un punto en que el agua no podrá disolver más. En ese momento, la disolución está «saturada». La sal extra que añadas no se disolverá y se irá al fondo del vaso.
Si calientas el agua, podrá disolver más sal. Esto significa que la solubilidad de la sal en el agua aumenta con la temperatura. Si enfrías el agua, disolverá menos sal.
Formas de medir la concentración
Podemos hablar de la concentración de dos maneras:
- Cualitativa (o empírica): Usamos palabras como "diluida" o "concentrada". No damos un número exacto.
- Cuantitativa (o numérica): Usamos números y unidades para ser muy precisos.
Ejemplos de concentración en la vida diaria
El alcohol que se usa en casa no es alcohol puro. Es una disolución de alcohol en agua. Si la etiqueta dice "70% V/V", significa que el 70% es alcohol y el 30% es agua. El alcohol es el soluto y el agua es el disolvente.
El zumo de naranja que compras puede decir "60% V/V". Esto significa que el 60% es zumo de naranja y el 40% es agua. La tintura de yodo al 5% tiene 5% de yodo disuelto en 95% de alcohol.
Concentración cualitativa: ¿Diluida o concentrada?
Cuando hablamos de concentración de forma cualitativa, usamos adjetivos. Decimos "diluido" o "débil" para disoluciones con poca concentración. Decimos "concentrado" o "fuerte" para disoluciones con mucha concentración.
Estos términos nos ayudan a entender cómo se ve o sabe una disolución. Por ejemplo, un café muy oscuro y con mucho sabor está concentrado. Una limonada con poco sabor está diluida.
- Disolución diluida: Tiene una cantidad pequeña de soluto en un volumen grande de disolvente.
- Disolución concentrada: Tiene una cantidad considerable de soluto en un volumen determinado.
Por ejemplo, el azúcar en el café es una disolución diluida. La miel es una disolución concentrada, porque tiene muchos azúcares disueltos en el agua.
| Diluida | Concentrada |
|---|---|
| Tiene una cantidad de soluto disuelto relativamente pequeña. | Contiene cantidades relativamente grandes de soluto disuelto. |
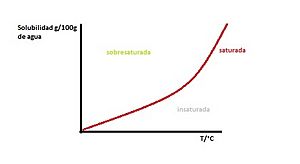
Insaturada, saturada y sobresaturada
También podemos clasificar las disoluciones según su solubilidad:
- Disolución insaturada: El soluto no ha alcanzado su límite máximo de disolución. Todavía puede disolver más soluto.
- Disolución saturada: El soluto ha alcanzado su límite máximo de disolución. No puede disolver más soluto a esa temperatura y presión.
- Disolución sobresaturada: Contiene más soluto del que normalmente podría disolver una disolución saturada. Esto se logra calentando la disolución para disolver más soluto y luego enfriándola lentamente. Son inestables; un pequeño movimiento puede hacer que el soluto extra se precipite (se separe y caiga al fondo).
| Insaturada | Saturada | Sobresaturada |
|---|---|---|
| Contiene menos soluto del que puede disolver. | Contiene la máxima cantidad de soluto que se disuelve a una temperatura específica. | Contiene más soluto del que se soporta en equilibrio a una temperatura dada. |
Concentración en términos cuantitativos
Para la ciencia o la industria, necesitamos medidas exactas de la concentración. Aquí te explicamos algunas de las más comunes:
Porcentaje masa-masa (% m/m)
Este porcentaje nos dice cuántos gramos de soluto hay por cada 100 gramos de la disolución total.
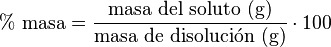
Por ejemplo, si disuelves 20 gramos de azúcar en 80 gramos de agua, la disolución total pesa 100 gramos (20+80). El porcentaje masa-masa es: Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \frac{20}{20 + 80}\cdot 100 = 20\ %
Porcentaje volumen-volumen (% v/v)
Este porcentaje indica el volumen de soluto por cada 100 unidades de volumen de la disolución. Se usa mucho para mezclas de líquidos o gases.

Por ejemplo, si una disolución de alcohol en agua es del 20% v/v, significa que hay 20 mililitros de alcohol por cada 100 mililitros de la disolución. La graduación alcohólica de las bebidas se expresa así. Un vino de 12 grados tiene un 12% v/v de alcohol.
Porcentaje masa-volumen (% m/v)
Este porcentaje relaciona la masa del soluto con el volumen de la disolución. Se expresa en gramos de soluto por cada 100 mililitros de disolución.
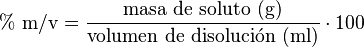
Molaridad (M)
La molaridad es una forma muy común de expresar la concentración en química. Nos dice cuántas "moles" de soluto hay en cada litro de disolución. Una "mol" es una unidad que agrupa muchísimas partículas (como átomos o moléculas).
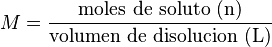
Por ejemplo, si disuelves 0.5 moles de un soluto en 1000 mililitros (1 litro) de disolución, la concentración es de 0.5 M (0.5 molar).
Molalidad (m)
La molalidad es el número de moles de soluto que hay en cada kilogramo de disolvente. A diferencia de la molaridad, la molalidad no cambia con la temperatura o la presión, lo que la hace muy precisa.
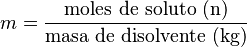
Normalidad (N)
La normalidad es otra forma de medir la concentración, que se usa en reacciones químicas específicas. Se basa en los "equivalentes" de soluto por litro de disolución. Un equivalente es la cantidad de sustancia que reacciona con otra.
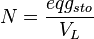
Normalidad ácido-base
Cuando una disolución se usa como ácido o como base, la normalidad se calcula según cuántos protones (H+) cede un ácido o cuántos hidroxilos (OH–) cede una base.
- Una disolución 1 M de HCl (que cede 1 H+) es 1 N.
- Una disolución 1 M de Ca(OH)2 (que cede 2 OH–) es 2 N.
Normalidad redox
Esta normalidad se usa cuando una disolución participa en reacciones donde se intercambian electrones (reacciones de oxidación-reducción o "redox"). Se basa en la cantidad de electrones que se intercambian.
Concentraciones muy pequeñas
Para medir cantidades muy, muy pequeñas de una sustancia disuelta, se usan las unidades:
- Partes por millón (ppm)
- Partes por "billón" (ppb)
- Partes por "trillón" (ppt)
Un millón es 106, un billón (en Estados Unidos) es 109 y un trillón (en Estados Unidos) es 1012. Estas unidades son útiles para medir, por ejemplo, la cantidad de dióxido de carbono en el aire.
Por ejemplo, 1 ppm de CO2 en el aire puede significar una molécula de CO2 por cada millón de moléculas de aire. En disoluciones de agua, 1 ppm es como 1 miligramo de soluto por cada litro de disolución.
Otras formas de indicar la concentración
Densidad
Aunque la densidad no es una medida directa de concentración, está relacionada con ella. A veces, para disoluciones muy comunes, se indica la densidad en lugar de la concentración. Sin embargo, esta práctica es cada vez menos frecuente.
Escala Baumé
La escala Baumé se usa para medir la concentración de algunos líquidos, como jarabes o ácidos. Fue creada por el químico francés Antoine Baumé en 1768. Cada división de esta escala se llama grado Baumé (ºB o ºBé).
Escala Brix
Los grados Brix (símbolo °Bx) se usan para saber la cantidad de sacarosa (azúcar) disuelta en un líquido. Si una disolución tiene 25 °Bx, significa que hay 25 gramos de azúcar por cada 100 gramos de líquido. Esta escala se usa mucho en la fabricación de zumos, vinos y azúcar.
|
Véase también
 En inglés: Concentration Facts for Kids
En inglés: Concentration Facts for Kids
- Disolvente
- Disolución
- Soluto
- Solubilidad