Disolución para niños

Una disolución o solución es una mezcla especial donde dos o más sustancias puras se unen de forma tan completa que no puedes distinguirlas a simple vista, ni siquiera con un microscopio potente. Es como si se hubieran vuelto una sola cosa.
En una disolución, siempre hay una sustancia que se disuelve y otra que la disuelve. La que disuelve se llama disolvente y la que se disuelve se llama soluto.
Un ejemplo muy común es cuando disuelves sal o azúcar en agua. El agua es el disolvente y la sal o el azúcar son los solutos. Pero las disoluciones no son solo de sólidos en líquidos. También pueden ser de gases en líquidos (como el oxígeno en el agua de los ríos), de líquidos en líquidos (como el alcohol en agua), o incluso de sólidos en sólidos (como en las aleaciones de metales).
El término "disolución" también se usa para hablar del proceso de disolver algo.
Contenido
¿Qué es el disolvente y el soluto?
En una disolución, el disolvente (también llamado solvente) es la sustancia que está en mayor cantidad y que disuelve a las otras. Los solutos son las sustancias que se disuelven en el disolvente.
Por ejemplo, en un vaso de agua con azúcar, el agua es el disolvente y el azúcar es el soluto.
Tipos de mezclas según el tamaño de las partículas
Un científico llamado Wilhelm Ostwald clasificó las mezclas según el tamaño de las partículas del soluto:
- Suspensiones: Las partículas del soluto son grandes y se pueden ver. Con el tiempo, se asientan en el fondo. Un ejemplo es la arena en agua.
- Coloides: Las partículas son más pequeñas que en las suspensiones, pero más grandes que en las disoluciones verdaderas. No se asientan fácilmente. La leche es un coloide.
- Disoluciones verdaderas: Las partículas del soluto son tan pequeñas (a nivel de moléculas o iones) que se mezclan perfectamente con el disolvente y no se pueden ver ni separar fácilmente.
Disoluciones que conducen electricidad
Algunas disoluciones pueden conducir la electricidad, mientras que otras no.
- Los electrólitos son sustancias que, al disolverse en agua, forman una disolución que sí conduce la electricidad. Esto ocurre porque el soluto se separa en partículas con carga eléctrica llamadas iones.
- Los no electrólitos son sustancias que, al disolverse en agua, forman una disolución que no conduce la electricidad.
Características de las disoluciones
Las disoluciones tienen algunas características importantes:
- Son mezclas homogéneas: Esto significa que se ven iguales en todas sus partes. No puedes distinguir los diferentes componentes.
- No se pueden separar fácilmente: No puedes separar el soluto del disolvente usando métodos simples como la centrifugación o la filtración. Necesitas otros métodos, como la destilación o la cristalización.
- El volumen no siempre se suma: Si mezclas 1 litro de agua y 1 litro de alcohol, el volumen final no será exactamente 2 litros. Esto se debe a cómo las moléculas se acomodan.
- La cantidad de soluto y disolvente puede variar: Puedes tener una disolución con mucha sal o con poca sal. La cantidad máxima de soluto que un disolvente puede disolver se llama solubilidad.
- Sus propiedades físicas cambian: Cuando añades un soluto a un disolvente, algunas propiedades cambian. Por ejemplo, el agua salada hierve a una temperatura más alta y se congela a una temperatura más baja que el agua pura.
- Las propiedades químicas no cambian: Las sustancias que forman la disolución mantienen sus propiedades químicas individuales. La sal sigue siendo sal y el agua sigue siendo agua, aunque estén mezcladas.
Tipos de disoluciones por su estado
Las disoluciones pueden formarse con sustancias en diferentes estados (sólido, líquido, gas).
Disoluciones sólidas
- Sólido en sólido: Un ejemplo son las aleaciones, como el bronce (una mezcla de cobre y estaño).
- Gas en sólido: El hidrógeno puede disolverse en metales como el paladio.
- Líquido en sólido: Las amalgamas dentales son un ejemplo, donde el mercurio (líquido) se mezcla con plata (sólido).
Disoluciones líquidas
- Sólido en líquido: El ejemplo más común es el azúcar o la sal disueltos en agua.
- Gas en líquido: El oxígeno disuelto en el agua de los océanos, que es vital para los peces. También el dióxido de carbono en las bebidas gaseosas.
- Líquido en líquido: El alcohol en agua, como en muchas bebidas.
Disoluciones gaseosas
- Gas en gas: El aire es el mejor ejemplo. Es una mezcla de nitrógeno, oxígeno y otros gases.
- Sólido en gas: El polvo en el aire es un ejemplo, aunque no es una disolución "verdadera" en el sentido más estricto, sino más bien una suspensión.
- Líquido en gas: El aire húmedo, donde hay vapor de agua (líquido) disuelto en el aire (gas).
Ejemplos de disoluciones
Aquí tienes una tabla con más ejemplos:
| Disolvente | Soluto | ||
|---|---|---|---|
| Gas | Líquido | Sólido | |
| Líquido | El dióxido de carbono en agua, formando agua carbonatada. | El etanol (alcohol común) en agua. | La sacarosa (azúcar de mesa) en agua; el cloruro de sodio (sal de mesa) en agua. |
| Sólido | El hidrógeno se disuelve en los metales. | El mercurio en oro. | El acero, duraluminio, y otras aleaciones metálicas. |
Tipos de disoluciones por su concentración
La concentración nos dice cuánto soluto hay en una disolución. Podemos clasificar las disoluciones de dos maneras:
Disoluciones cualitativas (empíricas)
Estas clasificaciones son más generales y no usan números exactos:
- Disolución diluida: Tiene muy poca cantidad de soluto en comparación con el disolvente. Imagina un poco de jugo en mucha agua.
- Disolución concentrada: Tiene una cantidad considerable de soluto. Más jugo en la misma cantidad de agua.
- Disolución saturada: Contiene la máxima cantidad de soluto que el disolvente puede disolver a una temperatura y presión dadas. Si intentas añadir más soluto, ya no se disolverá.
- Disolución sobresaturada: Contiene más soluto del que normalmente podría disolver. Esto se logra calentando la disolución para disolver más soluto y luego enfriándola lentamente. Son inestables y el exceso de soluto puede separarse fácilmente.
Disoluciones cuantitativas (valoradas)
Estas disoluciones son muy precisas y se usan en ciencia y tecnología. Aquí sí se miden las cantidades exactas de soluto y disolvente.
- Soluciones valoradas iónicas: Son aquellas donde el soluto y el disolvente forman partículas con carga eléctrica (iones).
- Soluciones valoradas elementales: Se forman a partir de elementos puros.
- Soluciones valoradas formuladas: Se preparan calculando las cantidades exactas de cada componente.
Características de las disoluciones líquidas
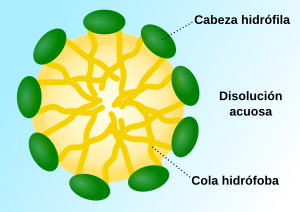
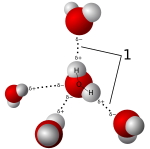
El agua es el disolvente más común y es muy especial. Las moléculas de agua son "polares", lo que significa que tienen un lado ligeramente positivo y otro ligeramente negativo. Esto les permite atraer y disolver muchas sustancias.
- Las sales se disuelven bien en disolventes polares como el agua. Las moléculas de agua rodean las partículas de sal con carga eléctrica, separándolas y disolviéndolas.
- Las sustancias polares se disuelven en disolventes polares. Por ejemplo, el alcohol se mezcla bien con el agua.
- Las sustancias no polares se disuelven mejor en disolventes no polares. Por ejemplo, el aceite y la grasa se mezclan entre sí, pero no con el agua. Por eso, si hay un derrame de petróleo en el océano, el petróleo flota en la superficie y no se mezcla con el agua.
Aplicaciones de las disoluciones
El estudio de las disoluciones es muy importante en la química y en la vida diaria. Dependiendo de las sustancias que se mezclan, las disoluciones siguen diferentes reglas:
- Para sólidos en líquidos, se estudian las leyes de la solubilidad.
- Para gases en líquidos, se aplica la Ley de Henry.
Véase también
 En inglés: Solution (chemistry) Facts for Kids
En inglés: Solution (chemistry) Facts for Kids