Presión de vapor para niños
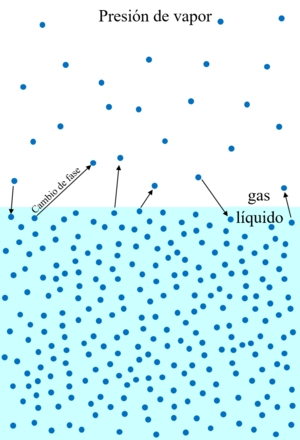
La presión de vapor es la presión que ejerce el vapor de una sustancia sobre su forma líquida (o sólida) en un recipiente cerrado. Esto ocurre cuando el líquido y el vapor están en un equilibrio dinámico, lo que significa que la cantidad de moléculas que se evaporan es igual a la cantidad de moléculas que se condensan. El valor de esta presión no cambia, siempre que haya suficiente líquido y vapor presentes. Los sólidos también pueden tener presión de vapor cuando pasan directamente a gas (sublimación).
Al principio, solo hay evaporación. Pero a medida que se forma más vapor, la presión dentro del recipiente aumenta. Esto hace que más vapor se convierta de nuevo en líquido (condensación). Con el tiempo, la velocidad de evaporación y la de condensación se igualan. En ese momento, se alcanza la presión de vapor máxima posible, también llamada presión de saturación. Esta presión solo puede aumentar si se añade más energía, como calor, lo que incrementa la temperatura.
El equilibrio se alcanza más rápido si la superficie de contacto entre el líquido y el vapor es grande. Por ejemplo, un charco de agua poco profundo se seca más rápido que uno profundo con la misma cantidad de agua, porque tiene más superficie expuesta. Sin embargo, la presión de vapor final será la misma en ambos casos.
La naturaleza del líquido es el factor más importante que determina su presión de vapor. Generalmente, entre líquidos parecidos, aquellos con moléculas más grandes tienen una presión de vapor menor a la misma temperatura. Por ejemplo, el aire a nivel del mar con vapor de agua a 20 °C tiene una presión parcial de 23 milibares de agua, junto con nitrógeno, oxígeno y argón.
La presión de vapor de cualquier sustancia aumenta a medida que sube la temperatura. Esto se describe con una fórmula llamada ecuación de Clausius-Clapeyron. El punto de ebullición de un líquido es la temperatura a la que su presión de vapor es igual a la presión del aire que lo rodea. Cuando la temperatura sube lo suficiente, la presión de vapor es tan alta que el líquido forma burbujas de vapor y hierve.
La presión que un solo componente de una mezcla (como el vapor de agua en el aire) aporta a la presión total se llama presión parcial. Por ejemplo, el aire a nivel del mar con vapor de agua a 20 °C tiene presiones parciales de agua, nitrógeno, oxígeno y argón que, sumadas, dan la presión atmosférica total.
Contenido
- ¿Cómo se mide la presión de vapor?
- ¿Cómo se calcula la presión de vapor?
- Presión de vapor y el punto de ebullición
- ¿Cómo cambia la presión de vapor con la temperatura?
- Presión de vapor en mezclas líquidas: Ley de Raoult
- Presión de vapor en sólidos
- Importancia de la presión de vapor
- Presión de vapor en la meteorología
- Galería de imágenes
- Véase también
¿Cómo se mide la presión de vapor?
La presión de vapor se mide en unidades de presión estándar. La unidad reconocida por el Sistema Internacional de Unidades (SI) es el pascal (Pa). Un pascal es igual a un newton por metro cuadrado.
Medir la presión de vapor es sencillo para presiones entre 1 y 200 kilopascales (kPa). Los resultados son más precisos cerca del punto de ebullición de la sustancia. Para medirla, se purifica la sustancia, se aísla en un recipiente sin otros gases y se mide la presión del vapor en equilibrio a diferentes temperaturas. Herramientas como el isoteniscopio ayudan a obtener mayor precisión.
¿Cómo se calcula la presión de vapor?
La ecuación de Antoine es una fórmula matemática que ayuda a calcular la relación entre la presión de vapor y la temperatura de líquidos o sólidos puros. Se obtiene ajustando datos experimentales y se adapta a cómo la presión de vapor suele aumentar con la temperatura.
La forma básica de la ecuación es:
- Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): {\displaystyle \log P = A-\frac{B}{C+T}}
Y se puede transformar para calcular la temperatura:
- Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): {\displaystyle T = \frac{B}{A-\log P} - C}
Donde:
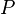 es la presión de vapor de la sustancia.
es la presión de vapor de la sustancia.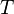 es la temperatura de la sustancia.
es la temperatura de la sustancia.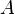 ,
, 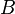 y
y 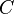 son números específicos para cada sustancia.
son números específicos para cada sustancia.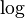 puede ser
puede ser 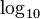 o Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \log_e (logaritmo en base 10 o logaritmo natural).
o Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \log_e (logaritmo en base 10 o logaritmo natural).
A veces se usa una versión más sencilla con solo dos números:
- Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): {\displaystyle \log P = A- \frac{B}{T}}
Estos cálculos son útiles, pero cada conjunto de números solo funciona bien en un rango de temperatura específico.
Presión de vapor y el punto de ebullición
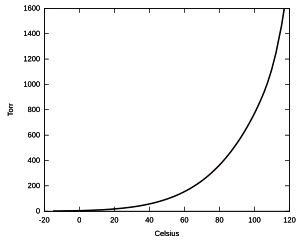
Un líquido está en equilibrio con su vapor cuando las moléculas de vapor alcanzan una cierta concentración. La presión que corresponde a esta concentración de moléculas de gas se llama presión de vapor del líquido a una temperatura dada. Esta presión nos dice cuánta concentración de vapor tendremos en el aire si hay saturación. Por ejemplo, el agua a 20 °C tiene una presión de vapor de unos 23,4 milibares. Esto significa que, si la humedad relativa es del 100% (saturación), el 2,34% del volumen del aire es vapor de agua.
La presión de vapor de cada líquido aumenta con la temperatura, porque las moléculas del líquido tienen más energía para escapar. Por eso, en lugares cálidos (como 40 °C), una humedad del 100% significa mucha más agua en el aire, lo que hace que el ambiente se sienta más pesado.
La temperatura a la que la presión de vapor de un líquido es igual a la presión del aire exterior se llama punto de ebullición del líquido. A esta temperatura, aparecen burbujas de vapor dentro del líquido que suben a la superficie. Por ejemplo, en una olla con agua hirviendo, las burbujas se forman en el fondo, donde el agua alcanza los 100 °C más rápido.
¿Cómo cambia la presión de vapor con la temperatura?
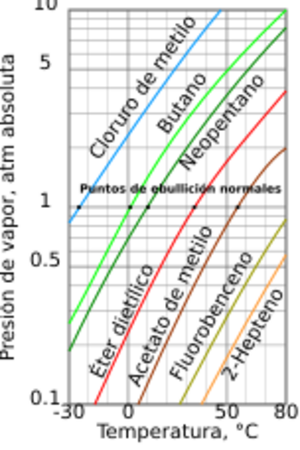
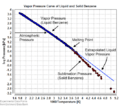
En general, la presión de vapor de los líquidos disminuye a medida que aumenta su temperatura de ebullición. El gráfico adjunto muestra cómo se comporta la presión de vapor de varios líquidos a diferentes temperaturas. Por ejemplo, el clorometano tiene la presión de vapor más alta de todos los líquidos mostrados en el gráfico a cualquier temperatura. También se puede ver que el propano hierve a una temperatura muy baja, -41 °C, donde su curva de presión de vapor cruza la línea de 1 atmósfera.
Aunque la relación entre la presión de vapor y la temperatura no es una línea recta, el gráfico usa un eje vertical especial (logarítmico) para que las líneas se vean casi rectas y así poder comparar varios líquidos en un solo dibujo.
Presión de vapor en mezclas líquidas: Ley de Raoult
La ley de Raoult nos ayuda a calcular la presión de vapor de mezclas de líquidos. Dice que la presión de vapor total de una mezcla es la suma de las presiones de vapor de cada componente, multiplicadas por su proporción en la mezcla.
La fórmula es:
- Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): P_{\rm tot} =\sum_i P y_i = \sum_i P_i^{\rm sat} x_i \,
Donde Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): P_{\rm tot} es la presión de vapor de la mezcla, 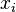 es la proporción del componente
es la proporción del componente 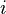 en el líquido y
en el líquido y 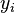 es la proporción del componente
es la proporción del componente 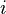 en el vapor. Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): P_i^{\rm sat} es la presión de vapor del componente
en el vapor. Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): P_i^{\rm sat} es la presión de vapor del componente 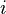 puro. Esta ley funciona mejor para moléculas que no tienen carga y que se atraen débilmente entre sí.
puro. Esta ley funciona mejor para moléculas que no tienen carga y que se atraen débilmente entre sí.
A veces, las mezclas tienen presiones de vapor más altas de lo que predice la ley de Raoult. Esto significa que las moléculas se atraen menos entre sí en la mezcla que cuando están solas. Un ejemplo es una mezcla de etanol y agua, que hierve a una temperatura más baja que cualquiera de sus componentes puros.
También hay mezclas con presiones de vapor más bajas de lo esperado. Esto indica que las moléculas se atraen más fuertemente entre sí en la mezcla. Un ejemplo es una mezcla de triclorometano y 2-propanona, que hierve a una temperatura más alta que cualquiera de sus componentes puros.
Presión de vapor en sólidos
La presión de vapor de equilibrio también existe para los sólidos. Es la presión que se alcanza cuando un sólido está en equilibrio con su propio vapor. Esto ocurre cuando la velocidad a la que un sólido se convierte en gas (sublimación) es igual a la velocidad a la que el gas se convierte de nuevo en sólido. Para la mayoría de los sólidos, esta presión es muy baja, pero hay excepciones como el naftaleno, el hielo seco y el hielo.
Todos los materiales sólidos tienen una presión de vapor, pero a menudo es tan baja que es difícil de medir. Se pueden usar técnicas como la termogravimetría para hacerlo. También hay métodos para calcular la presión de sublimación de un sólido, usando fórmulas que consideran el calor necesario para que el sólido se derrita.
Importancia de la presión de vapor
La presión de vapor es importante para entender cómo se comportan las sustancias en el ambiente. Por ejemplo, se usa para calcular el índice de peligrosidad de una sustancia, que nos dice qué tan probable es que se convierta en gas y se disperse en el aire. Esto es útil para decidir si una sustancia es segura para ciertas actividades.
Presión de vapor en la meteorología
En meteorología, la presión de vapor se refiere a la presión que ejerce el vapor de agua en la atmósfera, incluso si no está en equilibrio. Los meteorólogos también usan el término "presión de vapor de saturación" para hablar de la presión de vapor de equilibrio del agua sobre una superficie plana. Esto ayuda a distinguirla de la presión de vapor de equilibrio que considera la forma y el tamaño de las gotas de agua en el aire.
Galería de imágenes
-
Gráfico de la presión del vapor de agua.
-
Presión de vapor versus temperatura.
Véase también
 En inglés: Vapor pressure Facts for Kids
En inglés: Vapor pressure Facts for Kids