Energía de ionización para niños
La energía de ionización (Ei) es la cantidad de energía que se necesita para quitar un electrón de un átomo que está en estado gaseoso. Imagina que el átomo está tranquilo y solo, sin unirse a otros.
La fórmula para esto es: 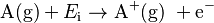 . Aquí,
. Aquí, 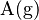 representa el átomo en estado gaseoso,
representa el átomo en estado gaseoso, 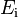 es la energía de ionización, y
es la energía de ionización, y 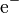 es el electrón que se quita.
es el electrón que se quita.
Esta es la primera energía de ionización. Si queremos quitar un segundo electrón, necesitamos una segunda energía de ionización. Esta segunda energía siempre es mayor que la primera. Esto ocurre porque, al quitar un electrón, el átomo se convierte en un ion positivo más pequeño. La fuerza que atrae a los electrones restantes hacia el centro del átomo (el núcleo) es más fuerte, ya que la carga positiva del núcleo sigue siendo la misma.
La energía de ionización se mide en unidades como electronvoltios (eV), julios (J) o kilojulios por mol (kJ/mol). Un electronvoltio es una unidad muy pequeña de energía: 1 eV = 1,6 × 10-19 J.
Contenido
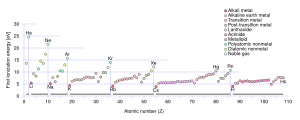
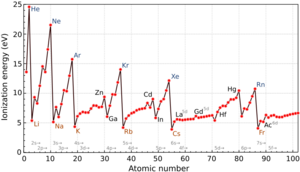
¿Cómo cambia la energía de ionización en la tabla periódica?
La energía de ionización sigue patrones interesantes en la tabla periódica.
Tendencias generales de la energía de ionización
Hay dos tendencias principales que nos ayudan a entender cómo cambia la energía de ionización:
- De izquierda a derecha en una fila (periodo): La energía de ionización generalmente aumenta. Esto significa que es más difícil quitar un electrón a los elementos que están más a la derecha en una misma fila.
- De arriba abajo en una columna (grupo): La energía de ionización generalmente disminuye. Esto significa que es más fácil quitar un electrón a los elementos que están más abajo en una misma columna.
Esta última tendencia se debe a que los electrones más externos están cada vez más lejos del núcleo a medida que bajamos en una columna. Al haber más capas de electrones, estos se sienten menos atraídos por el núcleo.
¿Por qué ocurren estas tendencias?
Varios factores influyen en la energía de ionización:
- Carga del núcleo: Si el núcleo tiene más carga positiva (más protones), atrae a los electrones con más fuerza. Esto hace que sea más difícil quitarlos, y la energía de ionización será mayor.
- Número de capas de electrones: Cuantas más capas de electrones tenga un átomo, más grande será. Los electrones más externos estarán más lejos del núcleo y serán menos atraídos, por lo que será más fácil quitarlos.
- Efecto pantalla: Los electrones de las capas internas "protegen" a los electrones externos de la atracción total del núcleo. Si este efecto es mayor, los electrones externos son menos atraídos y la energía de ionización es menor.
- Estabilidad de la configuración electrónica: Algunos átomos tienen una distribución de electrones muy estable. Por ejemplo, los gases nobles tienen sus capas de electrones completas, lo que los hace muy estables. Por eso, es muy difícil quitarles un electrón y tienen las energías de ionización más altas.
¿Hay excepciones a estas tendencias?
Sí, hay algunas excepciones a la regla general. Por ejemplo, la energía de ionización disminuye del berilio al boro, y del nitrógeno al oxígeno. Esto se explica por la forma en que los electrones se organizan en los orbitales (las "zonas" donde se mueven los electrones).
- En el boro, el último electrón está en un orbital diferente (2p) que está un poco más lejos del núcleo que los electrones del berilio (2s). Los electrones 2s del boro "protegen" al electrón 2p, haciendo que sea más fácil quitarlo.
- En el oxígeno, hay un electrón extra en un orbital que ya tiene otro electrón. Esta repulsión entre electrones hace que sea un poco más fácil quitar uno de ellos, comparado con el nitrógeno que tiene sus orbitales medio llenos, lo que es más estable.
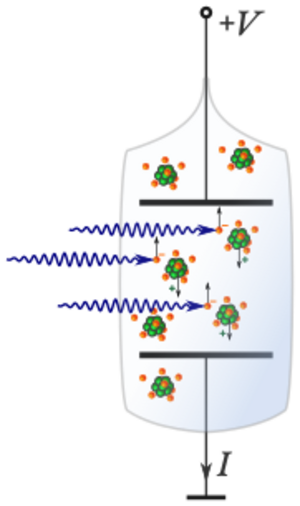
¿Cómo se mide la energía de ionización?
La forma más común de medir la energía de ionización es usando la espectroscopia atómica. Imagina que tienes átomos de un elemento en estado gaseoso. Se les envía luz ultravioleta o electrones con una energía conocida. Cuando la energía de la luz o de los electrones es suficiente, puede "arrancar" el electrón más débilmente unido del átomo.
Cuando esto sucede, el átomo se convierte en un ion positivo y el electrón liberado se mueve. Estos iones y electrones crean una pequeña corriente eléctrica que se puede medir. La energía mínima de la luz o de los electrones que causa esta corriente es la energía de ionización.
Valores de energía de ionización en la tabla periódica
Generalmente, quitar un segundo electrón siempre requiere más energía que quitar el primero, y así sucesivamente. Esto se debe a que, cada vez que quitas un electrón, la carga positiva del ion aumenta, atrayendo con más fuerza a los electrones restantes.
Aquí tienes algunos ejemplos de energías de ionización (en kJ/mol) para elementos del tercer periodo:
| Elemento | Primera | Segunda | Tercera | Cuarta | Quinta | Sexta | Séptima |
|---|---|---|---|---|---|---|---|
| Na | 496 | 4,560 | |||||
| Mg | 738 | 1,450 | 7,730 | ||||
| Al | 577 | 1,816 | 2,881 | 11,600 | |||
| Si | 786 | 1,577 | 3,228 | 4,354 | 16,100 | ||
| P | 1,060 | 1,890 | 2,905 | 4,950 | 6,270 | 21,200 | |
| S | 1,000 | 2,295 | 3,375 | 4,565 | 6,950 | 8,490 | 27,107 |
| Cl | 1,256 | 2,260 | 3,850 | 5,160 | 6,560 | 9,360 | 11,000 |
| Ar | 1,520 | 2,665 | 3,945 | 5,770 | 7,230 | 8,780 | 12,000 |
Observa los grandes saltos en la energía de ionización cuando se intenta quitar un electrón de una capa interna, como en el caso del magnesio. Quitar los dos primeros electrones (de la capa 3s) es relativamente fácil, pero el tercer electrón (de la capa 2p, que es una capa interna) requiere mucha más energía.
¿Qué elementos tienen la energía de ionización más baja o más alta?
- Los elementos alcalinos (Grupo 1) tienen las energías de ionización más bajas en sus periodos. Esto se debe a que tienen un solo electrón en su capa más externa, que es fácil de quitar.
- Los elementos alcalinotérreos (Grupo 2) tienen energías de ionización más altas que los alcalinos. Tienen dos electrones en su capa externa, y su configuración es más estable.
- Los gases nobles (Grupo 18) tienen las energías de ionización más altas. Su configuración electrónica es muy estable, lo que hace muy difícil quitarles un electrón.
- Los halógenos (Grupo 17) también tienen energías de ionización muy altas. Tienen una fuerte tendencia a ganar electrones para alcanzar la estabilidad de los gases nobles, en lugar de perderlos.
Galería de imágenes
Véase también
 En inglés: Ionization energy Facts for Kids
En inglés: Ionization energy Facts for Kids