Isótopo estable para niños
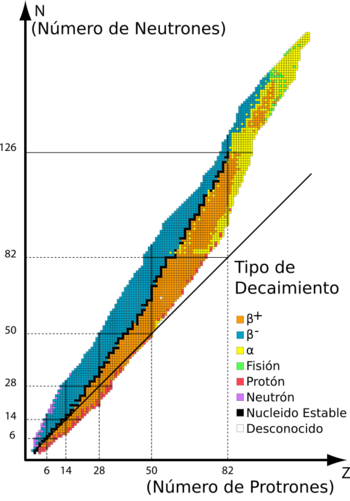
Los nucleidos en color naranja y en color azul son inestables, con los cuadrados negros entre estas regiones representando isótopos estables. La línea continua que pasa por debajo de muchos de los nucleidos representa la posición teórica en el gráfico de nucleidos para la que el número de protones es el mismo que el número de neutrones. El gráfico muestra que los elementos con más de 20 protones deben de tener más neutrones que protones para ser estables.
Un isótopo estable es un tipo de nucleido (un átomo con un número específico de protones y neutrones) que no es radiactivo. Esto significa que no se transforma de forma espontánea en otro átomo, a diferencia de los radionucleidos, que sí lo hacen.
Cada elemento químico puede tener uno o varios isótopos. Algunos de estos isótopos pueden ser estables, otros pueden ser inestables (llamados radioisótopos). Los isótopos inestables se transforman en otros nucleidos, liberando pequeñas partículas o energía.
| Tipo | Nucleido |
|---|---|
| Propiedad | No radiactivo |
| Número de nucleidos estables conocidos | 254 |
| Número de elementos con al menos un isótopo estable | 80 |
| Elementos sin isótopos estables | Tecnecio (43) y Prometio (61) |
Contenido
- ¿Qué son los Isótopos Estables?
- ¿Por qué algunos Isótopos son Estables y otros no?
- ¿Para qué se Usan los Isótopos Estables?
- ¿Cuántos Isótopos Estables Existen?
- ¿Pueden Cambiar los Isótopos "Estables"?
- Resumen de Tipos de Nucleidos
- Isótopos Estables en la Tabla Periódica
- Lista de Isótopos Estables
- Ver también
- Enlaces externos
- Véase también
¿Qué son los Isótopos Estables?
Los isótopos son versiones de un mismo elemento químico que tienen el mismo número de protones, pero diferente número de neutrones. Por ejemplo, el carbono siempre tiene 6 protones, pero puede tener 6, 7 u 8 neutrones. Estos son sus isótopos.
Un isótopo es "estable" si su núcleo atómico no se descompone con el tiempo. Los isótopos inestables, en cambio, se transforman en otros elementos liberando energía, un proceso que se conoce como desintegración radiactiva.
¿Por qué algunos Isótopos son Estables y otros no?
Se conocen alrededor de 2500 tipos de nucleidos, pero menos de 300 son estables. La estabilidad de un isótopo depende del equilibrio entre el número de protones (Z) y el número de neutrones (N) en su núcleo.
Una herramienta útil para entender esto es la carta de Segrè, un gráfico que muestra los isótopos estables. En este gráfico, los isótopos estables forman una franja estrecha.
- Para los átomos más ligeros, el número de protones y neutrones es casi igual.
- A medida que los átomos se hacen más pesados, necesitan más neutrones que protones para ser estables. La proporción de neutrones a protones puede llegar hasta 1.6 a 1.
Si un átomo tiene:
- Demasiados protones: El núcleo se vuelve inestable y puede romperse debido a la repulsión entre los protones.
- Demasiados neutrones: El núcleo también es inestable y un neutrón puede transformarse en un protón para buscar la estabilidad.
Además, no existen isótopos estables para los elementos con 43 (tecnecio), 61 (prometio) o 83 (bismuto) o más protones.
La Fuerza Nuclear y la Estabilidad
Dentro del núcleo de un átomo, los protones, que tienen carga positiva, se repelen entre sí debido a la fuerza electromagnética. Sin embargo, hay otra fuerza mucho más fuerte, llamada fuerza nuclear fuerte, que actúa como un "pegamento" y mantiene unidos a los protones y neutrones.
Esta fuerza nuclear fuerte solo funciona a distancias muy cortas. Por eso, cuando un núcleo se hace muy grande (con muchos protones, como los elementos con 83 o más protones), la fuerza nuclear fuerte ya no es suficiente para contrarrestar la repulsión de los protones. Esto hace que el núcleo sea inestable y se descomponga.
¿Para qué se Usan los Isótopos Estables?
Los isótopos estables son muy útiles en diferentes campos:
- Control de calidad de alimentos: Ayudan a saber de dónde vienen los alimentos y de qué están hechos.
- Ecología: Se usan para estudiar qué comen los animales en la naturaleza.
- Paleoclimatología: Permiten medir los gases atrapados en el hielo para entender el clima de la Tierra en el pasado.
¿Cuántos Isótopos Estables Existen?
La mayoría de los nucleidos que encontramos en la naturaleza son estables. Actualmente, se conocen 254 isótopos estables. También hay unos 34 nucleidos radiactivos que tienen un tiempo de vida tan largo que todavía existen en la naturaleza desde la formación del Sistema Solar. Estos se llaman nucleidos primordiales.
Algunos isótopos radiactivos naturales (alrededor de 51) tienen un tiempo de vida más corto, pero se forman continuamente. Esto ocurre por la desintegración de nucleidos primordiales (como el radio que viene del uranio) o por la interacción de rayos cósmicos con los elementos de la Tierra (como el carbono-14 que se forma del nitrógeno).
Se cree que los isótopos estables de la Tierra se formaron en procesos de creación de átomos, ya sea en el Big Bang (el inicio del universo) o dentro de estrellas que existieron antes de que se formara nuestro Sistema Solar.
Números Mágicos y la Estabilidad
La estabilidad de los isótopos también está relacionada con los "números mágicos" de protones o neutrones. Estos números (como 2, 8, 20, 28, 50, 82, 126) indican que el núcleo tiene "capas" completas de protones o neutrones, lo que le da una estabilidad extra. Por ejemplo, el estaño tiene 50 protones, un número mágico, y por eso tiene 10 isótopos estables, más que cualquier otro elemento.
Isótopos con Números Pares e Impares
La estabilidad de un isótopo también depende de si tiene un número par o impar de protones y neutrones:
- Los isótopos con un número par de protones y un número par de neutrones son los más estables y abundantes.
- Los isótopos con un número impar de protones y un número impar de neutrones son muy raros y suelen ser inestables. De los 254 isótopos estables conocidos, solo cinco tienen un número impar de protones y neutrones: hidrógeno-2 (deuterio), litio-6, boro-10, nitrógeno-14 y tántalo-180m.
Además, los elementos que solo tienen un isótopo estable (llamados elementos monoisotópicos) suelen tener un número impar de protones.
¿Qué pasa con los Isómeros Nucleares?
El tantalio-180m es un caso especial. Se le considera un isótopo estable, pero en realidad es un "isómero nuclear" o un estado de energía más alto de un átomo. Aunque teóricamente debería transformarse, su tiempo de vida es tan, tan largo (más de 1015 años) que nunca se ha observado su descomposición. Por eso, se le incluye en la lista de isótopos estables.
¿Pueden Cambiar los Isótopos "Estables"?
A veces, con el avance de la tecnología, se descubre que algunos isótopos que se consideraban estables en realidad son muy ligeramente radiactivos. Esto significa que se transforman, pero de forma extremadamente lenta.
Un ejemplo es el bismuto-209. Durante mucho tiempo se pensó que era estable, pero en 2003 se demostró que es muy ligeramente radiactivo, con un tiempo de vida de más de 1.9 x 1019 años (¡miles de millones de veces la edad del universo!).
Resumen de Tipos de Nucleidos
Aquí tienes una tabla que resume los diferentes tipos de nucleidos:
| Tipo de nucleidos por clase de estabilidad | Número de nucleidos de cada clase | Total acumulado de nucleidos en todas las clases | Notas |
|---|---|---|---|
| Teóricamente estables a todos los modos de decaimiento, aunque con posibilidad de decaimiento protónico. | 90 | 90 | Incluye los primeros 40 elementos. La desintegración de protones todavía no se ha observado. |
| Energéticamente inestables para uno o más modos de decaimiento conocidos, pero con decaimiento todavía no observado. Considerados estables hasta que se confirme su radiactividad. | 164 | 254 | La fisión espontánea es posible para nucleidos "estables" > niobio-93. Otros mecanismos posibles para nucleidos más pesados. El total son los nucleidos estables observados. |
| Nucleidos primordiales radiactivos. | 34 | 288 | Incluidos Bi, U, Th, Pu. |
| Nucleidos no primordiales radiactivos, pero presentes naturalmente en la Tierra. | ~ 51 | ~ 339 | Nucleidos cosmogénicos producidos por los rayos cósmicos; o subproductos de elementos radiactivos primordiales como el francio, etc. |
Isótopos Estables en la Tabla Periódica
La Tabla periódica es una forma de organizar los elementos químicos. De los elementos conocidos, 80 tienen al menos un isótopo estable. Estos son los primeros 82 elementos, desde el hidrógeno hasta el plomo, con dos excepciones: el tecnecio (elemento 43) y el prometio (elemento 61), que no tienen ningún isótopo estable.
A continuación, puedes ver una tabla periódica que muestra cuántos isótopos estables tiene cada elemento:
| H 2 |
He 2 |
||||||||||||||||
| Li 2 |
Be 1 |
B 2 |
C 2 |
N 2 |
O 3 |
F 1 |
Ne 3 |
||||||||||
| Na 1 |
Mg 3 |
Al 1 |
Si 3 |
P 1 |
S 4 |
Cl 2 |
Ar 3 |
||||||||||
| K 2 |
Ca 5 |
Sc 1 |
Ti 5 |
V 1 |
Cr 4 |
Mn 1 |
Fe 4 |
Co 1 |
Ni 5 |
Cu 2 |
Zn 5 |
Ga 2 |
Ge 4 |
As 1 |
Se 5 |
Br 2 |
Kr 6 |
| Rb 1 |
Sr 4 |
Y 1 |
Zr 4 |
Nb 1 |
Mo 6 |
Tc | Ru 7 |
Rh 1 |
Pd 6 |
Ag 2 |
Cd 6 |
In 1 |
Sn 10 |
Sb 2 |
Te 6 |
I 1 |
Xe 7 |
| Cs 1 |
Ba 6 |
* |
Hf 5 |
Ta 2 |
W 4 |
Re 1 |
Os 6 |
Ir 2 |
Pt 5 |
Au 1 |
Hg 7 |
Tl 2 |
Pb 4 |
Bi | Po | At | Rn |
| Fr | Ra | ** |
Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| * |
La 1 |
Ce 4 |
Pr 1 |
Nd 5 |
Pm | Sm 5 |
Eu 1 |
Gd 6 |
Tb 1 |
Dy 7 |
Ho 1 |
Er 6 |
Tm 1 |
Yb 7 |
Lu 1 |
||
| ** |
Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||
Lista de Isótopos Estables
Aquí tienes una lista de los isótopos que se consideran estables:
- Hidrógeno-1 (protio)
- Hidrógeno-2 (deuterio)
- Helio-3
- Hidrógeno-4
- Sin número de masa 5
- Litio-6
- Litio-7
- Sin número de masa 8
- Berilio-9
- Boro-10
- Boro-11
- Carbono-12
- Carbono-13
- Nitrógeno-14
- Nitrógeno-15
- Oxígeno-16
- Oxígeno-17
- Oxígeno-18
- Flúor-19
- Neón-20
- Neón-21
- Neón-22
- Sodio-23
- Magnesio-24
- Magnesio-25
- Magnesio-26
- Aluminio-27
- Silicio-28
- Silicio-29
- Silicio-30
- Fósforo-31
- Azufre-32
- Azufre-33
- Azufre-34
- Azufre-36
- Cloro-35
- Cloro-37
- Argón-36 (2E)
- Argón-38
- Argón-40
- Potasio-39
- Potasio-41
- Calcio-40 (2E)
- Calcio-42
- Calcio-43
- Calcio-44
- Calcio-46 (2B)
- Escandio-45
- Titanio-46
- Titanio-47
- Titanio-48
- Titanio-49
- Titanio-50
- Vanadio-51
- Cromo-50 (2E)
- Cromo-52
- Cromo-53
- Cromo-54
- Manganeso-55
- Hierro-54 (2E)
- Hierro-56
- Hierro-57
- Hierro-58
- Cobalto-59
- Níquel-58 (2E)
- Níquel-60
- Níquel-61
- Níquel-62
- Níquel-64
- Cobre-63
- Cobre-65
- Zinc-64 (2E)
- Zinc-66
- Zinc-67
- Zinc-68
- Zinc-70 (2B)
- Galio-69
- Galio-71
- Germanio-70
- Germanio-72
- Germanio-73
- Germanio-74
- Arsénico-75
- Selenio-74 (2E)
- Selenio-76
- Selenio-77
- Selenio-78
- Selenio-80 (2B)
- Bromo-79
- Bromo-81
- Kriptón-78 (2E)
- Kriptón-80
- Kriptón-82
- Kriptón-83
- Kriptón-84
- Kriptón-86 (2B)
- Rubidio-85
- Estroncio-84 (2E)
- Estroncio-86
- Estroncio-87
- Estroncio-88
- Itrio-89
- Circonio-90
- Circonio-91
- Circonio-92
- Circonio-94 (2B)
- Niobio-93 (SF)
- Molibdeno-92 (2E)
- Molibdeno-94 (SF)
- Molibdeno-95 (SF)
- Molibdeno-96 (SF)
- Molibdeno-97 (SF)
- Molibdeno-98 (2B)
- Tecnecio - No hay isótopos estables
- Rutenio-96 (2E)
- Rutenio-98 (SF)
- Rutenio-99 (SF)
- Rutenio-100 (SF)
- Rutenio-101 (SF)
- Rutenio-102 (SF)
- Rutenio-104 (2B)
- Rodio-103 (SF)
- Paladio-102 (2E)
- Paladio-104 (SF)
- Paladio-105 (SF)
- Paladio-106 (SF)
- Paladio-108 (SF)
- Paladio-110 (2B)
- Plata-107 (SF)
- Plata-109 (SF)
- Cadmio-106 (2E)
- Cadmio-108 (2E)
- Cadmio-110 (SF)
- Cadmio-111 (SF)
- Cadmio-112 (SF)
- Cadmio-114 (2B)
- Indio-113 (SF)
- Estaño-112 (2E)
- Estaño-114 (SF)
- Estaño-115 (SF)
- Estaño-116 (SF)
- Estaño-117 (SF)
- Estaño-118 (SF)
- Estaño-119 (SF)
- Estaño-120 (SF)
- Estaño-122 (2B)
- Estaño-124 (2B)
- Antimonio-121 (SF)
- Antimonio-123 (SF)
- Telurio-120 (2E)
- Telurio-122 (SF)
- Telurio-123 (E)
- Telurio-124 (SF)
- Telurio-125 (SF)
- Telurio-126 (SF)
- Yodo-127 (SF)
- Xenón-124 (2E)
- Xenón-126 (2E)
- Xenón-128 (SF)
- Xenón-129 (SF)
- Xenón-130 (SF)
- Xenón-131 (SF)
- Xenón-132 (SF)
- Xenón-134 (2B)
- Cesio-133 (SF)
- Bario-132 (2E)
- Bario-134 (SF)
- Bario-135 (SF)
- Bario-136 (SF)
- Bario-137 (SF)
- Bario-138 (SF)
- Lantano-139 (SF)
- Cerio-136 (2E)
- Cerio-138 (2E)
- Cerio-140 (SF)
- Cerio-142 (A, 2B)
- Praseodimio-141 (SF)
- Neodimio-142 (SF)
- Neodimio-143 (A)
- Neodimio-145 (A)
- Neodimio-146 (A, 2B)
- Neodimio-148 (A, 2B)
- Prometio - No hay isótopos estables
- Samario-144 (2E)
- Sin número de masa 147
- Samario-149 (A)
- Samario-150 (A)
- Samario-152 (A)
- Samario-154 (2B)
- Sin número de masa 151
- Europio-153 (A)
- Gadolinio-154 (A)
- Gadolinio-155 (A)
- Gadolinio-156 (SF)
- Gadolinio-157 (SF)
- Gadolinio-158 (SF)
- Gadolinio-160 (2B)
- Terbio-159 (SF)
- Disprosio-156 (A, 2E)
- Disprosio-158 (A, 2E)
- Disprosio-160 (A)
- Disprosio-161 (A)
- Disprosio-162 (A)
- Disprosio-163 (SF)
- Disprosio-164 (SF)
- Holmio-165 (A)
- Erbio-162 (A, 2E)
- Erbio-164 (A, 2E)
- Erbio-166 (A)
- Erbio-167 (A)
- Erbio-168 (A)
- Erbio-170 (A, 2B)
- Tulio-169 (A)
- Iterbio-168 (A, 2E)
- Iterbio-170 (A)
- Iterbio-171 (A)
- Iterbio-172 (A)
- Iterbio-173 (A)
- Iterbio-174 (A)
- Iterbio-176 (A, 2B)
- Lutecio-175 (A)
- Hafnio-176 (A)
- Hafnio-177 (A)
- Hafnio-178 (A)
- Hafnio-179 (A)
- Hafnio-180 (A)
- Tantalio-180m (A, B, E, IT) *
- Tantalio-181 (A)
- Wolframio-182 (A)
- Wolframio-183 (A)
- Wolframio-184 (A)
- Wolframio-186 (A, 2B)
- Renio-185 (A)
- Osmio-184 (A, 2E)
- Osmio-187 (A)
- Osmio-188 (A)
- Osmio-189 (A)
- Osmio-190 (A)
- Osmio-192 (A, 2B)
- Iridio-191 (A)
- Iridio-193 (A)
- Platino-192 (A)
- Platino-194 (A)
- Platino-195 (A)
- Platino-196 (A)
- Platino-198 (A, 2B)
- Oro-197 (A)
- Mercurio-196 (A, 2E)
- Mercurio-198 (A)
- Mercurio-199 (A)
- Mercurio-200 (A)
- Mercurio-201 (A)
- Mercurio-202 (A)
- Mercurio-204 (A, 2B)
- Talio-203 (A)
- Talio-205 (A)
- Plomo-204 (A)
- Plomo-206 (A)
- Plomo-207 (A)
- Plomo-208 (A)
- Bismuto ** y por encima de - Sin isótopos estables
A para la desintegración alfa, B para la desintegración beta, 2B para la desintegración beta doble, E para la captura de electrones, 2E para la captura de electrones doble, IT para la transición isomérica, SF para la fisión espontánea.
* El tantalio-180m es un "isótopo metaestable", lo que significa que es un isómero nuclear (un estado de energía más alto) de tántalo-180. Sin embargo, el tiempo de vida de este isómero nuclear es tan largo que nunca se ha observado su descomposición, y por lo tanto se comporta como un nucleido primordial "no radiactivo" en la práctica. Es el único caso de un isómero nuclear con un tiempo de vida tan largo que se incluye en esta lista.
** El bismuto-209 se consideró estable durante mucho tiempo, debido a su tiempo de vida inusualmente largo de más de 1.9 x 1019 años, lo que es más de mil millones de veces la edad del universo.
Ver también
- Geoquímica de isotopos
- Lista de elementos por estabilidad de isótopos
- Lista de nucleidos
- Elemento mononucleico
- Tabla periódica
- Nucleido primordial
- Radionucleido
- Proporción de isótopos estables
- Tabla de nucleidos
Enlaces externos
de:Isotop#Stabile Isotope sv:Stabil isotop
Véase también
 En inglés: Stable nuclide Facts for Kids
En inglés: Stable nuclide Facts for Kids

