Punto de fusión para niños
El punto de fusión es la temperatura a la que una sustancia cambia de estado sólido a líquido. Imagina un cubito de hielo: cuando lo calientas, llega un momento en que empieza a convertirse en agua líquida. Esa temperatura es su punto de fusión.
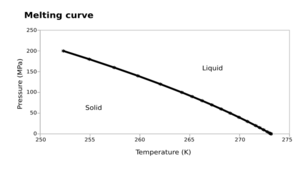
En el punto de fusión, la sustancia puede existir al mismo tiempo como sólido y como líquido, en un equilibrio. La temperatura de fusión puede variar un poco dependiendo de la presión del ambiente, por eso se suele indicar a una presión estándar, como la presión normal del aire.
Cuando el cambio es al revés, de líquido a sólido, se le llama punto de congelación o punto de cristalización. A veces, una sustancia líquida puede enfriarse por debajo de su punto de congelación sin volverse sólida, un fenómeno llamado sobreenfriamiento. Para saber el punto de congelación exacto, es más fácil observar cuándo desaparece el sólido (punto de fusión) que cuándo se forma el sólido.
Contenido
Ejemplos de Puntos de Fusión
Para la mayoría de las sustancias, el punto de fusión y el punto de congelación son casi iguales. Por ejemplo, el mercurio se funde y se congela a unos -38.8 °C.
Sin embargo, algunas sustancias son diferentes. Por ejemplo, el agar se derrite a 85 °C, pero se vuelve sólido a partir de 31 °C. Esto significa que su punto de fusión y congelación no son los mismos, un efecto llamado histéresis.
El punto de fusión del hielo, a la presión normal, es muy cercano a los 0 °C. A veces, el agua puede enfriarse mucho más, hasta -48.3 °C, antes de congelarse si no hay nada que ayude a formar los cristales de hielo.
Sustancias con Puntos de Fusión Extremos
El elemento químico con el punto de fusión más alto es el wolframio, que se funde a 3422 °C. Por eso se usa en los filamentos de las bombillas, ¡porque aguanta mucho calor!
El carbono no se funde a la presión normal, sino que pasa directamente de sólido a gas (se sublima) a unos 3700 °C. Para que el carbono se vuelva líquido, necesita una presión muy alta y temperaturas entre 4030 °C y 4430 °C.
En el otro extremo, el helio no se congela a la presión normal, ni siquiera a temperaturas muy cercanas al cero absoluto (la temperatura más fría posible). Necesita una presión muy alta para volverse sólido.
¿Cómo se Mide el Punto de Fusión?
Existen varias formas de medir el punto de fusión en un laboratorio.
Métodos de Laboratorio
- Banco Kofler: Es una tira de metal que se calienta de un lado a otro, creando un rango de temperaturas. Puedes colocar una sustancia en diferentes puntos de la tira para ver a qué temperatura se derrite.
- Aparato de Punto de Fusión Básico: Se usa un tubo de vidrio pequeño con la sustancia sólida. Este tubo se sumerge en un baño de aceite que se calienta lentamente. Con una lupa, se observa cuándo los cristales de la sustancia empiezan a derretirse y se registra la temperatura. Algunos aparatos modernos hacen esto automáticamente con sensores de luz.
Medición Continua
En algunas industrias, como las refinerías de petróleo, se mide el punto de congelación de sustancias como el diésel de forma continua. Esto significa que la muestra se toma directamente del proceso y se mide automáticamente, sin necesidad de llevarla a un laboratorio.
Técnicas para Materiales Muy Resistentes al Calor
Para materiales que se funden a temperaturas extremadamente altas (más de 1800 °C), como el platino o el wolframio, se usan métodos especiales. Se calienta el material en un horno y se mide su temperatura con un pirómetro óptico. Este aparato mide la luz que emite el material caliente para saber su temperatura.
La Ciencia Detrás de la Fusión
Para que un sólido se derrita, necesita absorber calor. Primero, el calor eleva su temperatura hasta el punto de fusión. Pero luego, necesita aún más calor para cambiar de sólido a líquido, incluso si la temperatura no sube. Este calor adicional se llama "calor de fusión" o "calor latente". Es como la energía extra que se necesita para romper los enlaces que mantienen unida la estructura sólida.
El punto de fusión cambia muy poco con la presión, mucho menos que el punto de ebullición. Esto se debe a que el cambio de sólido a líquido no implica un gran cambio de volumen. Si una sustancia es más densa como sólido que como líquido (como la mayoría), su punto de fusión subirá un poco si aumentas la presión. Pero en el caso del agua, que es menos densa como sólido (el hielo flota), su punto de fusión baja un poco si aumentas la presión.
Pureza y Punto de Fusión
Los puntos de fusión son muy útiles para saber si una sustancia es pura. Una sustancia pura siempre tiene un punto de fusión más alto y se derrite en un rango de temperatura muy pequeño. Si una sustancia tiene impurezas, su punto de fusión será más bajo y se derretirá en un rango de temperatura más amplio. Cuantas más impurezas, más bajo será el punto de fusión y más amplio el rango.
Los vidrios son diferentes a los sólidos cristalinos. No tienen un punto de fusión fijo. Cuando se calientan, se van ablandando poco a poco, volviéndose un líquido espeso.
Descenso Crioscópico
El punto de congelación de un líquido (como el agua) baja cuando le añades otra sustancia. Por ejemplo, si le pones sal al agua, se congelará a una temperatura más baja que el agua pura. Este efecto se usa para evitar que las cosas se congelen, como cuando se echa sal en las carreteras heladas o anticongelante en los coches.
La Regla de Carnelley
En química, existe una regla llamada la regla de Carnelley, que dice que las moléculas con una forma muy simétrica suelen tener un punto de fusión más alto. Por ejemplo, entre tres tipos de moléculas de la misma familia (isómeros), la que tiene la forma más simétrica se derrite a una temperatura más alta. Esto ocurre porque las moléculas simétricas pueden empaquetarse mejor en el estado sólido, lo que requiere más energía para separarlas y derretirlas.
Predicción del Punto de Fusión
Los científicos han desarrollado formas de predecir el punto de fusión de los materiales. Una de las primeras ideas fue el criterio de Lindemann, que dice que un material se derrite cuando las vibraciones de sus átomos se vuelven tan grandes que los átomos empiezan a chocar entre sí.
Hoy en día, se usan modelos informáticos avanzados para predecir los puntos de fusión de miles de compuestos químicos, lo que ayuda mucho en la investigación y el desarrollo de nuevos materiales.
Galería de imágenes
Véase también
 En inglés: Melting point Facts for Kids
En inglés: Melting point Facts for Kids