Radio covalente para niños
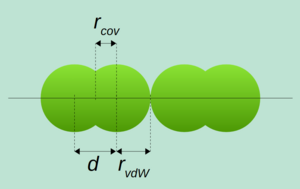
En química, el radio covalente es una medida del tamaño de un átomo cuando forma un enlace covalente con otro átomo. Imagina dos átomos iguales unidos: el radio covalente es la mitad de la distancia entre sus centros. Se mide en picómetros (pm) o ángstroms (Å), donde 1 Å es igual a 100 pm.
Aunque se esperaría que la suma de los radios covalentes de dos átomos fuera la longitud exacta del enlace entre ellos, esto no siempre es así. El tamaño de un átomo puede cambiar un poco dependiendo de cómo esté unido a otros átomos. Por eso, los valores de los radios covalentes que encuentras en tablas son promedios.
Los científicos miden las longitudes de los enlaces entre átomos usando técnicas como la difracción de rayos X. Un químico famoso, Linus Pauling, propuso que el radio covalente de un átomo era la mitad de la longitud de un enlace simple entre dos átomos de ese mismo elemento. Por ejemplo, en una molécula de hidrógeno (H₂), la distancia entre los dos átomos de hidrógeno es de 74.14 pm, así que el radio covalente del hidrógeno es 37.07 pm.
Contenido
¿Cómo se usan los Radios Covalentes?
Los radios covalentes son útiles para entender cómo se unen los átomos. La suma de los radios covalentes de dos átomos (A y B) nos da una idea de la longitud del enlace entre ellos: R(AB) = r(A) + r(B).
Tabla de Radios Covalentes
Existen tablas que muestran los radios covalentes de muchos elementos. Estos valores son calculados para ser consistentes entre sí. Aunque la tabla completa es muy larga, aquí te mostramos algunos ejemplos para que veas cómo varían:
| Z | Símbolo | r (Å) |
|---|---|---|
| 1 | H | 0.31 |
| 6 | C (sp3) | 0.75 |
| 8 | O | 0.66 |
| 9 | F | 0.57 |
| 17 | Cl | 1.02 |
| 53 | I | 1.39 |
¿Cómo varían los Radios Covalentes en la Tabla Periódica?
El radio covalente es una propiedad que sigue un patrón en la Tabla periódica de los elementos.
Tendencias en los Períodos
Cuando te mueves de izquierda a derecha en una fila (período) de la tabla periódica, el radio covalente generalmente se hace más pequeño. Esto ocurre porque los átomos tienen más protones en su núcleo, lo que atrae a los electrones con más fuerza y los acerca al centro del átomo. Por ejemplo, en el tercer período, el sodio (Na) tiene un radio covalente de 186 pm, mientras que el cloro (Cl) tiene uno de 99 pm.
A veces, después de que se llenan ciertos niveles de energía (como los orbitales d), el radio covalente puede aumentar un poco en lugar de disminuir. Esto se debe a que los nuevos electrones empiezan a ocupar niveles de energía más alejados del núcleo.
Tendencias en los Grupos
Cuando bajas por una columna (grupo) de la tabla periódica, el radio covalente generalmente aumenta. Esto sucede porque los átomos tienen más capas de electrones, lo que los hace más grandes. Por ejemplo, en el grupo 17 (los halógenos), el flúor (F) tiene el radio covalente más pequeño (64 pm), y el yodo (I) tiene el más grande (133 pm).
El elemento con el radio covalente más pequeño es el helio (He), con 37 pm, que está en la parte superior derecha de la tabla. El elemento con el radio covalente más grande es el francio (Fr), con 242 pm, que se encuentra en la parte inferior izquierda.
Radio Covalente del Flúor
El radio covalente del flúor es de unos 60 pm. Sin embargo, el flúor es un átomo muy pequeño y atrae mucho a los electrones (es muy electronegativo). Esto hace que sea difícil medir su radio covalente con mucha precisión.
El enlace entre dos átomos de flúor en una molécula de F₂ es un poco inusual, lo que hace que la distancia entre ellos sea más larga de lo esperado. Además, cuando el flúor se une a otros átomos, los enlaces suelen ser muy "polares" (los electrones no se comparten por igual), lo que complica el uso de su radio covalente para predecir la longitud de esos enlaces.
Cuando un átomo de flúor gana un electrón y se convierte en un ion (F⁻), su tamaño aumenta mucho, llegando a unos 133 pm. Esto se debe a que, al tener un electrón extra, la atracción del núcleo sobre los electrones es un poco más débil, permitiendo que la nube de electrones se expanda.
Ver también
- Enlace covalente
- Radio atómico
- Radio iónico
- Radio de Van der Waals
- Longitud de enlace
- Tabla periódica de los elementos
Véase también
 En inglés: Covalent radius Facts for Kids
En inglés: Covalent radius Facts for Kids