Radio atómico para niños
El radio atómico es una medida que nos ayuda a entender el tamaño de los átomos. Imagina un átomo como una pequeña esfera. El radio atómico es la distancia desde el centro de esa esfera (donde está el núcleo) hasta su borde exterior, donde se encuentran los electrones.
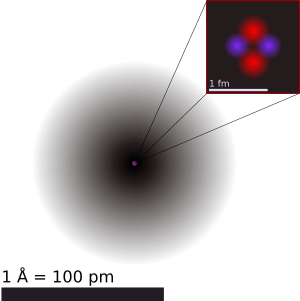
1 Å (ángstrom) equivale a 100 pm (picómetros), que equivale a 100.000 fm (femtómetros).
En el centro se puede ver (fuera de escala) el núcleo del átomo, y en el extremo superior derecho se ve una ampliación del núcleo, con dos protones y dos neutrones.
La escala indica el tamaño de un fm (femtómetro).
Los electrones en un átomo no giran en órbitas fijas como planetas alrededor del sol. En cambio, se mueven en una "nube" o "zona de probabilidad" alrededor del núcleo. El radio atómico nos da una idea de qué tan lejos se extiende esta nube de electrones.
El tamaño de los átomos es increíblemente pequeño. Los radios de los átomos neutros suelen estar entre 30 y 300 picómetros (pm). Un picómetro es una billonésima parte de un metro (0.000.000.000.001 metros). Para que te hagas una idea, el radio de un átomo es más de 10.000 veces más grande que el radio de su núcleo, pero mucho más pequeño que la longitud de onda de la luz visible.
Aunque los átomos no son esferas perfectas, a menudo los científicos los representan así para entender mejor cómo se comportan. Esta idea nos ayuda a explicar cosas como la densidad de los materiales, cómo se mueven los líquidos y sólidos, y cómo se forman las moléculas.
Contenido
¿Cómo se mide el radio atómico?
En 1920, los científicos comenzaron a medir el tamaño de los átomos usando una técnica llamada difracción de rayos X. Al principio, pensaron que todos los átomos de un mismo elemento tendrían el mismo tamaño. Sin embargo, con más datos, se dieron cuenta de que el tamaño de un átomo puede variar un poco dependiendo de cómo esté unido a otros átomos en diferentes materiales.
Tipos de radio atómico
Existen diferentes maneras de definir y medir el radio atómico, dependiendo de cómo se encuentre el átomo:
- Radio de Van der Waals: Imagina dos átomos que no están unidos, pero están muy cerca el uno del otro. El radio de Van der Waals es la mitad de la distancia más pequeña entre los núcleos de esos dos átomos.
- Radio iónico: Cuando un átomo gana o pierde electrones, se convierte en un ion. El radio iónico es el tamaño de ese ion, y se calcula a partir de la distancia entre los núcleos de iones en cristales.
- Radio covalente: Cuando dos átomos comparten electrones para formar un enlace covalente (como en una molécula de agua), el radio covalente es la mitad de la distancia entre sus núcleos.
- Radio metálico: En los metales, los átomos están unidos de una manera especial. El radio metálico es la mitad de la distancia entre los núcleos de átomos vecinos en un metal sólido.
- Radio de Bohr: Este es un concepto más antiguo, basado en un modelo de átomo que ya no se usa completamente. Sin embargo, el radio de Bohr para el átomo de hidrógeno (que solo tiene un electrón) sigue siendo una medida importante en la física.
¿Cómo cambia el radio atómico en la tabla periódica?
El radio atómico sigue patrones interesantes en la tabla periódica:
¿Por qué el radio atómico aumenta hacia abajo en un grupo?
En un mismo grupo (una columna vertical de la tabla periódica), el radio atómico generalmente aumenta a medida que bajas. Esto se debe a que los átomos de abajo tienen más capas de electrones. Cada nueva capa de electrones está más lejos del núcleo, haciendo que el átomo sea más grande.
¿Por qué el radio atómico disminuye de izquierda a derecha en un periodo?
En el mismo periodo (una fila horizontal de la tabla periódica), el radio atómico disminuye de izquierda a derecha. A medida que avanzas en una fila, el número de protones en el núcleo aumenta. Más protones significan una carga positiva más fuerte en el núcleo, que atrae a los electrones con más fuerza. Aunque también hay más electrones, la atracción del núcleo es más fuerte y "jala" las capas de electrones más cerca, haciendo que el átomo sea más pequeño.
¿Qué es el efecto de apantallamiento?
Los electrones que están en las capas internas de un átomo "protegen" o "apantallan" a los electrones de las capas externas de la atracción total del núcleo. Esto significa que los electrones más externos no sienten toda la fuerza de los protones. Este efecto de apantallamiento ayuda a que el radio atómico aumente hacia abajo en un grupo, ya que hay más capas internas que apantallan.
¿Qué es la contracción de los lantánidos?
Hay una excepción interesante a estas reglas, especialmente en los elementos llamados lantánidos (que están en la parte inferior de la tabla periódica). Los electrones de una capa específica (la 4f) no son muy buenos para apantallar la carga del núcleo. Esto hace que los elementos que vienen después de los lantánidos sean más pequeños de lo que se esperaría. Por ejemplo, el hafnio es casi del mismo tamaño que el circonio, aunque debería ser más grande.
Valores del radio atómico
La siguiente tabla muestra los radios covalentes medidos para los elementos, publicados por J. C. Slater en 1964. Los valores están en picómetros (pm). El color del recuadro va del rojo al amarillo a medida que aumenta el radio; el gris indica que no hay datos.
| Grupo (columna) |
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||
| Periodo (fila) |
|||||||||||||||||||||
| 1 | H 25 |
He |
|||||||||||||||||||
| 2 | Li 145 |
Be 105 |
B 85 |
C 70 |
N 65 |
O 60 |
F 50 |
Ne |
|||||||||||||
| 3 | Na 180 |
Mg 150 |
Al 125 |
Si 110 |
P 100 |
S 100 |
Cl 100 |
Ar |
|||||||||||||
| 4 | K 220 |
Ca 180 |
Sc 160 |
Ti 140 |
V 135 |
Cr 140 |
Mn 140 |
Fe 140 |
Co 135 |
Ni 135 |
Cu 135 |
Zn 135 |
Ga 130 |
Ge 125 |
As 115 |
Se 115 |
Br 115 |
Kr |
|||
| 5 | Rb 235 |
Sr 200 |
Y 180 |
Zr 155 |
Nb 145 |
Mo 145 |
Tc 135 |
Ru 130 |
Rh 135 |
Pd 140 |
Ag 160 |
Cd 155 |
In 155 |
Sn 145 |
Sb 145 |
Te 140 |
I 140 |
Xe |
|||
| 6 | Cs 260 |
Ba 215 |
* |
Lu 175 |
Hf 155 |
Ta 145 |
W 135 |
Re 135 |
Os 130 |
Ir 135 |
Pt 135 |
Au 135 |
Hg 150 |
Tl 190 |
Pb 180 |
Bi 160 |
Po 190 |
At |
Rn |
||
| 7 | Fr |
Ra 215 |
** |
Lr |
Rf |
Db |
Sg |
Bh |
Hs |
Mt |
Ds |
Rg |
Cn |
Nh |
Fl |
Mc |
Lv |
Ts |
Og |
||
| * |
La 195 |
Ce 185 |
Pr 185 |
Nd 185 |
Pm 185 |
Sm 185 |
Eu 185 |
Gd 180 |
Tb 175 |
Dy 175 |
Ho 175 |
Er 175 |
Tm 175 |
Yb 175 |
|||||||
| ** |
Ac 195 |
Th 180 |
Pa 180 |
U 175 |
Np 175 |
Pu 175 |
Am 175 |
Cm |
Bk |
Cf |
Es |
Fm |
Md |
No |
|||||||
Galería de imágenes
Véase también
 En inglés: Atomic radius Facts for Kids
En inglés: Atomic radius Facts for Kids


