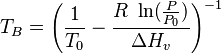Punto de ebullición para niños
El punto de ebullición de una sustancia es la temperatura a la cual un líquido se convierte en vapor. Esto ocurre cuando la presión que el líquido ejerce hacia afuera (su presión de vapor) se iguala a la presión que lo rodea, como la del aire.
El punto de ebullición de un líquido puede cambiar según la presión del ambiente. Por ejemplo, si la presión es baja (como en la cima de una montaña), el líquido hierve a una temperatura más baja. Si la presión es alta, el líquido hierve a una temperatura más alta. El agua, por ejemplo, hierve a 100 °C (212 °F) al nivel del mar, pero a unos 93.4 °C (200.1 °F) si estás a 1905 metros de altura. Cada líquido tiene su propio punto de ebullición a una presión específica.
Contenido
- ¿Qué es el Punto de Ebullición Normal?
- ¿Cómo Afectan las Moléculas al Punto de Ebullición?
- Punto de Ebullición Estándar de los Elementos
- Temperatura y Presión de Saturación
- ¿Cómo se Relaciona el Punto de Ebullición con la Presión de Vapor?
- ¿Cómo Afectan las Impurezas y Mezclas al Punto de Ebullición?
- Véase también
¿Qué es el Punto de Ebullición Normal?
El punto de ebullición normal (o punto de ebullición atmosférico) es la temperatura a la que un líquido hierve cuando la presión del aire es la estándar al nivel del mar (conocida como 1 atmósfera). A esta temperatura, el vapor dentro del líquido tiene suficiente fuerza para formar burbujas y escapar. Desde 1982, la IUPAC (una organización internacional de químicos) define el punto de ebullición estándar como la temperatura a la que algo hierve bajo una presión de 1 bar.
¿Qué es el Calor de Vaporización?
El calor de vaporización es la cantidad de energía que se necesita para cambiar una cierta cantidad de una sustancia de líquido a gas, manteniendo una presión constante.
¿Cuál es la Diferencia entre Evaporación y Ebullición?
Los líquidos pueden convertirse en vapor de dos maneras:
- Evaporación: Es un proceso lento que ocurre solo en la superficie del líquido, a temperaturas por debajo del punto de ebullición. Las moléculas de la superficie que tienen suficiente energía escapan al aire como vapor.
- Ebullición: Es un proceso rápido que ocurre en todo el líquido, no solo en la superficie. Las moléculas en cualquier parte del líquido ganan suficiente energía para formar burbujas de vapor que suben y escapan.
¿Cómo Afectan las Moléculas al Punto de Ebullición?
La temperatura de una sustancia depende de la energía con la que se mueven sus moléculas. A temperaturas por debajo del punto de ebullición, solo unas pocas moléculas en la superficie tienen la energía necesaria para romper la "piel" del líquido (la tensión superficial) y escapar. Cuando un líquido hierve, las moléculas ganan mucha energía y se mueven libremente.
El punto de ebullición también depende de:
- La masa de las moléculas: Las moléculas más pesadas suelen necesitar más energía para separarse.
- Las fuerzas entre las moléculas: Algunas moléculas se atraen más entre sí que otras. Si las fuerzas son fuertes (como los puentes de hidrógeno), se necesita más energía para separarlas y hacer que hiervan.
¿Existe un Límite para el Punto de Ebullición?
Sí, el punto de ebullición no puede subir infinitamente. A medida que la presión aumenta, el gas se vuelve tan denso que es difícil distinguirlo del líquido. A esta temperatura se le llama temperatura crítica, y por encima de ella, no hay una fase líquida clara. El helio tiene el punto de ebullición normal más bajo (–268.9 °C), mientras que el wolframio tiene el más alto (5930 °C).
Punto de Ebullición Estándar de los Elementos
En las tablas de química, a menudo se muestra el punto de ebullición de una sustancia en condiciones estándar, es decir, a una presión de 1 atmósfera (1013.25 hPa). Este es el punto de ebullición normal.
La siguiente tabla muestra las temperaturas de ebullición de algunos elementos en estado estándar (1 atm) en °C:
| H -252,8 |
He -268,9 |
||||||||||||||||
| Li 1342 |
Be 2471 |
B 4000 |
C 3825 |
N -195,8 |
O -183 |
F -188,1 |
Ne -246,1 |
||||||||||
| Na 882,9 |
Mg 1090 |
Al 2519 |
Si 3265 |
P 280,5 |
S 444,6 |
Cl -34 |
Ar -185,8 |
||||||||||
| K 759 |
Ca 1484 |
Sc 2836 |
Ti 3287 |
V 3407 |
Cr 2671 |
Mn 2061 |
Fe 2861 |
Co 2927 |
Ni 2913 |
Cu 2562 |
Zn 907 |
Ga 2204 |
Ge 2833 |
As 616 |
Se 685 |
Br 58,8 |
Kr -153,3 |
| Rb 688 |
Sr 1382 |
Y 3345 |
Zr 4409 |
Nb 4744 |
Mo 4639 |
Tc 4265 |
Ru 4150 |
Rh 3695 |
Pd 2963 |
Ag 2162 |
Cd 767 |
In 2072 |
Sn 2602 |
Sb 1587 |
Te 988 |
I 184,4 |
Xe -108,1 |
| Cs 671 |
Ba 1897 |
* |
Hf 4603 |
Ta 5458 |
W 5930 |
Re 5627 |
Os 5012 |
Ir 4428 |
Pt 3825 |
Au 2856 |
Hg 356,6 |
Tl 1473 |
Pb 1749 |
Bi 1564 |
Po 962 |
At | Rn -61,7 |
| Fr 677 |
Ra 1737 |
** |
Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| * |
La 3464 |
Ce 3443 |
Pr 3520 |
Nd 3074 |
Pm 3000 |
Sm 1794 |
Eu 1529 |
Gd 3273 |
Tb 3230 |
Dy 2567 |
Ho 2700 |
Er 2868 |
Tm 1950 |
Yb 1196 |
Lu 3402 |
||
| ** |
Ac 3198 |
Th 4788 |
Pa 4027 |
U 4131 |
Np 4273 |
Pu 3228 |
Am 2011 |
Cm 3100 |
Bk | Cf | Es | Fm | Md | No | Lr | ||
Temperatura y Presión de Saturación
Un líquido saturado es un líquido que ha absorbido toda la energía térmica posible sin empezar a hervir. De manera similar, un vapor saturado es un vapor que tiene la menor energía térmica posible sin empezar a convertirse en líquido.
La temperatura de saturación es lo mismo que el punto de ebullición. Es la temperatura a la que un líquido hierve y se convierte en vapor a una presión específica. Si se añade más energía térmica a un líquido saturado, cambiará de estado.
Si la presión se mantiene constante, un vapor a su temperatura de saturación empezará a convertirse en líquido si se le quita energía. De igual forma, un líquido a su temperatura y presión de saturación hervirá y se convertirá en vapor si se le añade más energía.
El punto de ebullición depende de la presión del ambiente. Por eso, en lugares altos como el Monte Everest (a 8848 metros), donde la presión del aire es mucho menor (unos 34 kPa), el agua hierve a solo 71 °C (160 °F). El punto de ebullición aumenta con la presión hasta el punto crítico, donde el gas y el líquido se vuelven indistinguibles. No se puede aumentar el punto de ebullición más allá de este punto.
| Símbolo | Nombre | Valor | Unidad |
|---|---|---|---|
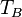 |
Punto de ebullición normal | K | |
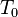 |
Temperatura conocida | K | |
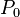 |
Presión conocida | Pa | |
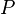 |
Presión de vapor a 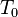 |
Pa | |
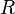 |
Constante universal de los gases | 8.314 | J / (mol K) |
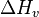 |
Entalpía de vaporización | J / mol |
La presión de saturación es la presión a la que un líquido hierve y se convierte en vapor a una temperatura específica. La presión y la temperatura de saturación están directamente relacionadas: si una aumenta, la otra también lo hace.
Si la temperatura se mantiene constante, un vapor a su presión y temperatura de saturación empezará a convertirse en líquido si la presión del sistema aumenta. De manera similar, un líquido a su presión y temperatura de saturación tenderá a convertirse en vapor si la presión del sistema disminuye.
El punto de ebullición normal del agua es de 99.97 °C (211.9 °F) a una presión de 1 atmósfera (101.325 kPa). La IUPAC recomienda un punto de ebullición estándar del agua de 99.61 °C (211.3 °F) a una presión estándar de 100 kPa (1 bar).
¿Cómo se Relaciona el Punto de Ebullición con la Presión de Vapor?
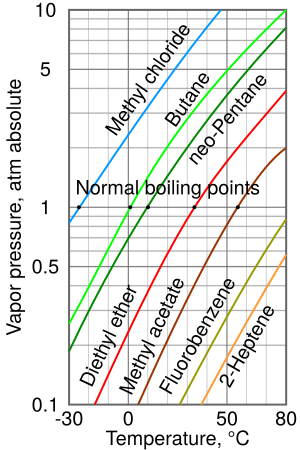
Cuanto mayor sea la presión de vapor de un líquido a una temperatura dada, menor será su punto de ebullición normal. Esto significa que si un líquido libera vapor fácilmente, hervirá a una temperatura más baja.
El gráfico de presión de vapor a la derecha muestra cómo la presión de vapor cambia con la temperatura para varios líquidos. Puedes ver que los líquidos con las presiones de vapor más altas tienen los puntos de ebullición normales más bajos.
Por ejemplo, a cualquier temperatura, el cloruro de metilo tiene la presión de vapor más alta de todos los líquidos en el gráfico. Por eso, también tiene el punto de ebullición normal más bajo (–24.2 °C).
El punto crítico de un líquido es la temperatura más alta (y la presión) a la que realmente puede hervir.
¿Cómo Afectan las Impurezas y Mezclas al Punto de Ebullición?
Cuando se añaden impurezas a un líquido puro, su punto de ebullición puede cambiar.
- Impurezas no volátiles: Si añades algo que no se evapora fácilmente (como sal en agua), el punto de ebullición del líquido aumentará. Esto se llama elevación del punto de ebullición. Por eso, el agua salada hierve a una temperatura más alta que el agua pura.
- Mezclas de líquidos: Si mezclas dos o más líquidos que se evaporan, cada uno tiene su propio punto de ebullición. La presencia de los otros líquidos en la mezcla afecta la presión de vapor y, por lo tanto, los puntos de ebullición de todos los componentes. La destilación es un proceso que aprovecha estas diferencias para separar los líquidos de una mezcla.
Véase también
 En inglés: Boiling point Facts for Kids
En inglés: Boiling point Facts for Kids
- Elevación de punto de ebullición
- Punto crítico (termodinámica)
- Superheating
- Punto triple