Entalpía de vaporización para niños
La entalpía de vaporización es la cantidad de energía que necesita una sustancia para cambiar completamente de estado líquido a estado gaseoso. Imagina que hierves agua: esa energía que le das para que se convierta en vapor es la entalpía de vaporización. Se representa con el símbolo 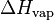 .
.
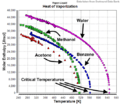
Esta energía es necesaria porque las moléculas en un líquido están unidas entre sí. Para que se separen y se muevan libremente como un gas, necesitan absorber calor. El valor de la entalpía de vaporización cambia con la temperatura: disminuye a medida que la temperatura sube. Si la temperatura es muy alta, las fases líquida y gaseosa ya no se distinguen.
La entalpía de vaporización se suele medir a la temperatura normal de ebullición de una sustancia.
Contenido
Unidades de medida de la entalpía de vaporización
La entalpía de vaporización se mide en diferentes unidades. Las más comunes son:
- Julios por mol (J/mol) o kilojulios por mol (kJ/mol): Esto se refiere a la energía necesaria para vaporizar una cantidad específica de sustancia llamada "mol".
- Kilojulios por kilogramo (kJ/kg) o julios por gramo (J/g): Estas unidades se usan para la energía necesaria por cada kilogramo o gramo de sustancia.
Entalpía de condensación: Lo opuesto a la vaporización
La entalpía de condensación es lo contrario de la entalpía de vaporización. Es la energía que una sustancia libera cuando pasa de estado gaseoso a estado líquido.
- Cuando una sustancia se vaporiza (pasa de líquido a gas), absorbe calor, por eso la entalpía de vaporización es siempre un valor positivo.
- Cuando una sustancia se condensa (pasa de gas a líquido), libera calor, por eso la entalpía de condensación es siempre un valor negativo.
Piensa en el vapor de agua que se convierte en gotas de agua en una ventana fría: ese vapor está liberando calor al condensarse.
¿Por qué es importante la entalpía de vaporización?
La entalpía de vaporización nos ayuda a entender cuánta energía se necesita para cambiar el estado de una sustancia. Esto es muy útil en muchas áreas, desde la cocina hasta la ingeniería.
La energía para el cambio de estado
La entalpía de vaporización es la energía que se necesita para que las moléculas de un líquido se separen y se conviertan en gas. En el líquido, las moléculas están unidas por fuerzas de atracción. Para que se liberen y se muevan como un gas, necesitan esa energía extra.
Por ejemplo, el helio tiene una entalpía de vaporización muy baja (0,0845 kJ/mol) porque sus átomos apenas se atraen entre sí. En cambio, el agua tiene una entalpía de vaporización alta (40,65 kJ/mol) porque sus moléculas están fuertemente unidas por algo llamado "enlaces de hidrógeno". Por eso, se necesita mucha más energía para hervir agua que para calentar la misma cantidad de agua.
Aplicaciones de la entalpía de vaporización
La entalpía de vaporización es muy importante en el transporte de calor y en muchos procesos de la vida diaria y la tecnología.
- Enfriamiento por evaporación: Este principio se usa para enfriar cosas. Cuando un líquido se evapora, absorbe calor del ambiente, lo que causa un enfriamiento.
* Tu cuerpo se enfría cuando sudas: el sudor se evapora de tu piel y se lleva el calor. * Las torres de refrigeración en las industrias usan este método para enfriar agua. * Algunos refrigeradores antiguos funcionaban sin electricidad usando este principio.
- Calderas de condensación: En las casas, las calderas modernas aprovechan la entalpía de condensación. Cuando queman gas, producen vapor de agua. Estas calderas enfrían ese vapor para que se condense, liberando el calor que se había absorbido al vaporizarse. Así, recuperan esa energía y son más eficientes.
- Efectos de enfriamiento no deseados:
* Si tienes la piel o la ropa mojada, te puedes congelar más fácilmente porque el agua al evaporarse te quita calor. * Cuando se extrae gas de recipientes de gas líquido (como el propano), las tuberías se enfrían mucho porque el gas absorbe calor al vaporizarse.
- Licuefacción de gases: Para convertir un gas en líquido, hay que quitarle mucha energía, enfriándolo o aumentando la presión. Esto se debe a que el gas debe liberar su entalpía de condensación para volverse líquido.
- Ciclones tropicales: Estos fenómenos naturales obtienen su enorme energía del calor que se libera cuando grandes masas de vapor de agua se condensan en la atmósfera.
Enfriamiento por evaporación en motores
Antiguamente, algunos motores, especialmente los estacionarios (que no se mueven) y los de tractores, usaban un sistema de enfriamiento por evaporación.
- El motor tenía una "camisa de agua" alrededor del cilindro.
- Se llenaba con agua por una abertura grande.
- Cuando el motor funcionaba y se calentaba, el agua hervía y se evaporaba.
- El vapor salía por la abertura, y el motor se mantenía a una temperatura constante de 100 °C (a nivel del mar) mientras hubiera agua.
La ventaja de este sistema era su sencillez, ya que no necesitaba bombas ni radiadores. Sin embargo, tenía desventajas: consumía mucha agua (varios cubos al día) y el motor era muy grande y pesado. Por estas razones, este tipo de enfriamiento dejó de usarse en los países desarrollados alrededor de 1950, aunque todavía se fabrica en algunos lugares por su bajo costo y facilidad de reparación.
Valores de entalpía de vaporización para algunas sustancias
Aquí tienes algunos ejemplos de entalpías de vaporización, medidas en sus puntos de ebullición normales:
| Compuesto | Entalpía de vaporización (KJ mol−1) |
Calor de vaporización (KJ kg−1) |
|---|---|---|
| Agua | 40,656 | 2257 |
| Acetona | 32,0 | |
| Amoníaco | 23,4 | 1371 |
| Argón | 6,5 * | |
| Benceno | 30,8 * | |
| Butano | 21,0 | 320 |
| Etanol | 43,5 | 841 |
| Fosfina | 14,6 | 429,4 |
| Helio | 0,084 * | |
| Hidrógeno | 0,46 | 451,9 |
| Mercurio | 59,3 * | |
| Metano | 8,2 | 760 |
| Metanol | 35,3 | 1104 |
| Propano | 15,7 | 356 |
* a 1 bar
Galería de imágenes
Véase también
 En inglés: Enthalpy of vaporization Facts for Kids
En inglés: Enthalpy of vaporization Facts for Kids