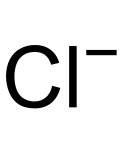Cloruro para niños
Datos para niños
Cloruro |
||
|---|---|---|
 |
||
| Nombre IUPAC | ||
| Cloruro | ||
| General | ||
| Fórmula molecular | Cl- | |
| Identificadores | ||
| ChEBI | 17996 | |
| ChEMBL | 19429 | |
| ChemSpider | 306 | |
| PubChem | 312 | |
| KEGG | C00698 | |
|
[Cl-]
|
||
|
InChI
InChI=1S/ClH/h1H/p-1
Key: VEXZGXHMUGYJMC-UHFFFAOYSA-M |
||
| Propiedades físicas | ||
| Masa molar | 35,45 g/mol | |
| Compuestos relacionados | ||
| Fluoruro | F- | |
| Bromuro | Br- | |
| Ioduro | I- | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
Los cloruros son iones especiales que se forman a partir del cloruro de hidrógeno. Son compuestos que tienen un átomo de cloro con una carga eléctrica de -1. Esto significa que el cloro ha ganado un electrón para completar su capa exterior.
Contenido
- ¿Qué son los cloruros inorgánicos?
- ¿Qué son los cloruros orgánicos?
- Propiedades del ion cloruro
- Reacciones del cloruro
- Otros compuestos de cloro
- ¿Dónde se encuentra el cloruro en la naturaleza?
- Importancia del cloruro en la biología
- Corrosión causada por cloruros
- Efectos del cloruro en el medio ambiente
- Ver también
- Véase también
¿Qué son los cloruros inorgánicos?
Características de los cloruros inorgánicos
Los cloruros inorgánicos contienen el anión Cl−. Son como las sales del ácido clorhídrico (HCl). Generalmente, son sustancias sólidas sin color y necesitan mucho calor para derretirse.
Algunos cloruros pueden tener un tipo de unión llamada covalente. Por ejemplo, el cloruro de mercurio (II) (HgCl2) se convierte en gas a temperaturas bajas. Por eso, antes se le llamaba "sublimato".
El cloruro de hierro (III) (FeCl3) también tiene un poco de este tipo de unión. La mayoría de los cloruros se disuelven bien en agua. Las excepciones son el cloruro de mercurio (I) (Hg2Cl2), el cloruro de plata (AgCl) y el cloruro de talio (I) (TlCl).
Si hay sustancias que quitan electrones (oxidantes fuertes), los cloruros pueden convertirse en cloro puro. Esto también se puede hacer con electrólisis. De hecho, la electrólisis del cloruro sódico disuelto es la forma más común de obtener cloro y hidróxido de sodio.
¿Cómo se forman los cloruros inorgánicos?
Los cloruros se pueden crear mezclando una base (como un óxido o un hidróxido) con ácido clorhídrico.
Algunos metales, como el zinc, reaccionan directamente con el ácido clorhídrico. Esto produce hidrógeno y el cloruro correspondiente. Por ejemplo: Zn + 2 HCl → ZnCl2 + H2
También es posible que los elementos reaccionen directamente entre sí. Sin embargo, esta reacción puede ser muy fuerte.
¿Dónde encontramos los cloruros inorgánicos?
El cloruro más conocido es la sal de mesa, que se encuentra en el agua del mar. El agua de mar tiene una concentración de sal de aproximadamente 3-3.5%. Por eso, los océanos son una fuente casi ilimitada de cloruro.
¿Cómo se detectan los cloruros inorgánicos?
Los cloruros que se disuelven en agua pueden detectarse. Si añades nitrato de plata a una solución ácida con cloruros, se forma un sólido blanco llamado cloruro de plata. Este sólido se disuelve en amoníaco y vuelve a aparecer si se le añade ácido nítrico.
Propiedades de los cloruros inorgánicos
Solubilidad en agua
La mayoría de los cloruros son muy solubles en agua. Esto significa que se disuelven fácilmente. Sin embargo, algunos, como el cloruro de plata, el cloruro de plomo (II) y el cloruro de mercurio (I), no se disuelven tan bien.
Densidad
La densidad de los cloruros varía según el elemento al que estén unidos. La densidad es una medida de cuánto material hay en un espacio determinado.
¿Qué son los cloruros orgánicos?
Características de los cloruros orgánicos
En los cloruros orgánicos, el cloro está unido directamente a un átomo de carbono. Aunque es un enlace covalente, tiene una parte de carga eléctrica. Por eso, el cloro puede ser reemplazado en algunas reacciones químicas.
Los cloruros orgánicos son menos inflamables que los hidrocarburos (compuestos de carbono e hidrógeno). A menudo, también pueden ser más perjudiciales. Algunos, como el diclorometano, se usan como disolventes.
¿Cómo se forman los cloruros orgánicos?
Los cloruros de compuestos orgánicos se pueden obtener haciendo reaccionar la sustancia directamente con cloro. Esta reacción suele ser fuerte.
También se pueden obtener transformando otros grupos químicos en cloruro. Por ejemplo, los grupos que tienen oxígeno e hidrógeno (hidroxi) pueden ser reemplazados por cloruro usando ácido clorhídrico.
Otra forma es añadir cloro o ácido clorhídrico a compuestos con enlaces dobles o triples, como los alquenos o alquinos.
Los cloruros aromáticos (compuestos con anillos de carbono) se suelen obtener añadiendo cloro directamente en una reacción especial, con la ayuda de un ácido de Lewis como catalizador.
¿Cómo se detectan los cloruros orgánicos?
Hay dos formas principales de saber si un compuesto orgánico tiene cloruro:
- Prueba de Beilstein: Calienta un alambre de cobre en una llama azul. Luego, toca el compuesto orgánico con el alambre y vuelve a ponerlo en la llama. Si la llama se vuelve verde azulada, hay cloruro. Otros elementos similares al cloro pueden dar la misma reacción.
- Transformación en cloruro inorgánico: Calienta una pequeña muestra con un poco de sodio metal (¡con mucho cuidado!). Luego, vierte el contenido en agua, añade ácido nítrico y, finalmente, nitrato de plata. Si hay cloruro, se formará un sólido blanco, como en la prueba de los cloruros inorgánicos.
Cloruros orgánicos en la naturaleza
En la naturaleza, hay pocos cloruros orgánicos. Por eso, no se descomponen fácilmente y pueden permanecer en el ambiente por mucho tiempo. Como no se mezclan bien con el agua, se acumulan en las grasas de los seres vivos, especialmente en los animales que están al final de la cadena alimenticia. Esto puede causar problemas de salud.
Propiedades del ion cloruro
Un ion cloruro (Cl−) es más grande que un átomo de cloro. Esto se debe a que el ion cloruro tiene un electrón extra. El ion no tiene color y no es magnético. En agua, se disuelve muy bien en la mayoría de los casos.
Reacciones del cloruro
El cloruro puede ser oxidado, lo que significa que puede perder electrones. La primera oxidación convierte el cloruro en cloro gaseoso. El cloro puede oxidarse aún más para formar otros compuestos, como el hipoclorito (ClO−), que es el ingrediente activo de la lejía.
El cloruro es una base débil. Esto significa que puede aceptar un protón (un ion de hidrógeno) de ácidos fuertes, como el ácido sulfúrico:
- NaCl + H2SO4 → NaHSO4 + HCl
La presencia de iones cloruro se puede detectar usando nitrato de plata. Una solución con iones cloruro formará un sólido blanco de cloruro de plata:
- Cl− + Ag+ → AgCl
La cantidad de cloruro en una muestra se puede medir con un aparato llamado cloridómetro.
Otros compuestos de cloro
El cloro puede tener diferentes cargas eléctricas, desde -1 hasta +7. Aquí te mostramos algunos ejemplos de compuestos de cloro con diferentes cargas:
| Carga del cloro | −1 | +1 | +3 | +5 | +7 |
|---|---|---|---|---|---|
| Nombre | cloruro | hipoclorito | clorito | clorato | perclorato |
| Fórmula | Cl− | ClO− | ClO− 2 |
ClO− 3 |
ClO− 4 |
| Estructura |  |
 |
 |
¿Dónde se encuentra el cloruro en la naturaleza?
En la naturaleza, el cloruro se encuentra principalmente en el agua de mar. El agua de mar tiene una gran cantidad de iones cloruro. También se encuentra en algunos mares interiores y pozos subterráneos de agua salada, como el Gran Lago Salado en Utah (EE.UU.) y el Mar Muerto en Israel y Jordania.
La mayoría de las sales de cloruro se disuelven en agua. Por eso, los minerales que contienen cloruro se encuentran en lugares con climas secos o muy profundos bajo tierra. Algunos minerales con cloruro son la halita (sal de mesa, NaCl), la silvita (KCl) y la bischofita (MgCl2∙6H2O).
Importancia del cloruro en la biología
El cloruro es muy importante para los seres vivos. Ayuda a regular la presión dentro de las células, el equilibrio de los líquidos y el balance de acidez en el cuerpo. El cloruro está en todos los líquidos del cuerpo y es el ion más abundante fuera de las células.
Es un elemento esencial que ayuda a mantener el equilibrio de las células y a transmitir señales en las neuronas (células nerviosas). Puede moverse a través de canales especiales en las células.
La concentración de cloruro en la sangre se llama cloruro sérico. Los riñones son los encargados de regular esta concentración. El ion cloruro también es parte de algunas proteínas, como la enzima amilasa. Por estas razones, el cloruro es uno de los minerales que necesitamos en nuestra alimentación.
Corrosión causada por cloruros
La presencia de cloruros, como en el agua de mar, puede hacer que los metales se oxiden y se deterioren más rápido. Esto se llama corrosión por picadura. Afecta a muchos metales, incluyendo los aceros inoxidables y el aluminio. En el hormigón, los cloruros pueden dañar el acero que está dentro, causando que se oxide.
Efectos del cloruro en el medio ambiente
Un aumento en la cantidad de cloruro puede tener varios efectos en el agua y en la tierra. Puede hacer que los arroyos se vuelvan más ácidos. También puede afectar la vida de las plantas y los animales acuáticos.
Además, puede permitir que organismos de agua salada invadan ambientes que antes eran de agua dulce. El cloruro de sodio también puede cambiar la composición de los microbios (organismos muy pequeños) y dificultar procesos importantes para la calidad del agua.
Ver también
Véase también
 En inglés: Chloride Facts for Kids
En inglés: Chloride Facts for Kids