Calor específico para niños
La capacidad calorífica específica, también conocida como calor específico, es una magnitud física que nos dice cuánta energía en forma de calor se necesita para aumentar la temperatura de una cantidad específica de una sustancia. Imagina que tienes un trozo de metal; su calor específico te indica cuánto calor debes darle para que su temperatura suba un grado. Se representa con la letra `c` (minúscula).
De manera similar, la capacidad calorífica (con la letra `C` mayúscula) es la cantidad de calor que se necesita para aumentar la temperatura de un objeto completo. Por lo tanto, el calor específico es la capacidad calorífica dividida por la masa del objeto, es decir, `c = C / m`, donde `m` es la masa de la sustancia.
Contenido
¿Qué es la Capacidad Calorífica Específica?
El calor específico es una característica única de cada material. Es como una huella digital que nos dice cuánto calor puede absorber. Por ejemplo, el agua tiene un calor específico muy alto. Esto significa que necesita mucha energía para calentarse, y por eso los océanos ayudan a mantener la temperatura de la Tierra más estable.
Cuanto mayor sea el calor específico de una sustancia, más energía calorífica se necesita para que su temperatura aumente. Por ejemplo, se requiere ocho veces más energía para calentar un lingote de magnesio que un lingote de plomo de la misma masa.
El término "calor específico" fue usado por primera vez por el físico Joseph Black. En su época, la mecánica y la termodinámica se veían como ciencias separadas. Aunque hoy podríamos llamarlo "transferencia de energía calorífica específica", el nombre original se ha mantenido.
Fórmulas Básicas del Calor Específico
Para calcular el calor específico promedio en un rango de temperaturas, usamos esta fórmula:
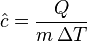
Aquí, `Q` es la cantidad de calor que se transfiere, `m` es la masa de la sustancia y `ΔT` es el cambio de temperatura.
Si el calor específico es casi constante en un rango de temperaturas, podemos usar una fórmula más sencilla para calcular el calor transferido:
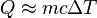
Esta fórmula nos dice que la cantidad de calor (`Q`) es igual a la masa (`m`) multiplicada por el calor específico (`c`) y por el cambio de temperatura (`ΔT`).
Cantidad de Sustancia
Cuando medimos el calor específico, la cantidad de sustancia se suele expresar en gramos o kilogramos (unidades del SI). Sin embargo, en química, a veces es útil usar el mol, que representa un número específico de moléculas o átomos. Cuando se usa el mol, se le llama calor específico molar. Si se usa la masa, se le llama calor específico másico.
Conceptos Relacionados
El calor específico se puede medir bajo diferentes condiciones. Por ejemplo, en los gases, se mide a presión constante (`cp`) o a volumen constante (`cv`). Las mediciones a presión constante suelen dar valores más altos porque el gas también realiza un trabajo al expandirse.
La relación entre el calor específico a presión constante y a volumen constante se llama coeficiente adiabático (`γ`). Este valor es importante en fórmulas físicas, como la que calcula la velocidad del sonido en un gas.
El calor específico de la mayoría de las sustancias no es un valor fijo, sino que puede cambiar un poco con la temperatura. Por ejemplo, el calor específico del agua varía ligeramente según la temperatura, aunque a menudo se considera constante para cálculos sencillos. La presión también es importante, especialmente para gases y líquidos.
Capacidad Calorífica de Sólidos, Líquidos y Gases
Al estudiar la capacidad calorífica, se han descubierto algunas reglas generales:
- Muchos sólidos tienen una capacidad calorífica cercana a un valor específico, lo que se explica por cómo se mueven sus átomos.
- Muchos gases también tienen capacidades caloríficas que dependen de su estructura molecular.
Unidades de Medida
Unidades del Calor
La unidad oficial para medir el calor en el Sistema Internacional es el julio (J).
A veces, todavía se usa la caloría (cal), especialmente en algunas aplicaciones científicas. Una caloría se define como la cantidad de calor necesaria para aumentar la temperatura de un gramo de agua destilada en 1 °C (de 14.5 °C a 15.5 °C) a la presión atmosférica. Sin embargo, la caloría no es una unidad reconocida por el Sistema Internacional y su uso no es recomendable en documentos oficiales.
En el sistema de unidades anglosajón, se usa la BTU. Se define de manera similar a la caloría, pero usando grados Fahrenheit y libras de agua.
Unidades de Calor Específico
En el Sistema Internacional, el calor específico se mide en julios por kilogramo y por kelvin (J·kg−1·K−1). Otra unidad común, aunque no del SI, es la caloría por gramo y por grado centígrado (cal·g−1·°C−1). Por ejemplo, el calor específico del agua es aproximadamente 1 cal/(g·°C).
En algunos países que usan el Sistema Anglosajón de Unidades, el calor específico se mide en BTU por libra y grado Fahrenheit.
Factores que Afectan el Calor Específico
Grados de Libertad
Las moléculas de los gases se mueven de diferentes maneras. Los gases con un solo átomo, como el helio, solo tienen movimientos de traslación (se mueven de un lado a otro, como pelotas rebotando). Esto significa que tienen tres "grados de libertad" para moverse.
Las moléculas con más átomos, como el nitrógeno (que tiene dos átomos), tienen más formas de moverse. Además de la traslación, pueden rotar y vibrar. Estos movimientos internos también almacenan energía. Por ejemplo, el nitrógeno tiene cinco grados de libertad: tres de traslación y dos de rotación. Cuantos más grados de libertad tenga una molécula, más energía puede almacenar, lo que afecta su calor específico.
Masa Molar
La masa molar es la masa de un mol de cualquier elemento o compuesto. Una de las razones por las que el calor específico varía entre sustancias es la diferencia en sus masas molares. La energía calorífica se almacena cuando los átomos o moléculas vibran. Si una sustancia tiene una masa molar más ligera, significa que cada gramo de ella tiene más átomos o moléculas disponibles para almacenar energía. Por eso, el hidrógeno, que tiene la masa molar más baja, tiene un calor específico muy alto: un gramo de hidrógeno contiene muchísimas moléculas.
Cuando el calor específico se mide en términos molares (por mol de sustancia), las diferencias entre las sustancias son menos grandes.
Impurezas
En el caso de las aleaciones (mezclas de metales), pequeñas cantidades de impurezas pueden cambiar mucho el calor específico. Esto ocurre incluso si la impureza es uno de los elementos que forman la aleación.
Tabla de Calores Específicos y Sustancias
| Sustancia | Fase | cp (másico) J·g−1·K−1 |
cp (molar) J·mol−1·K−1 |
cv (molar) J·mol−1·K−1 |
Capacidad calorífica volumétrica J cm−3 K−1 |
|---|---|---|---|---|---|
| Gas monoatómico (Ideal) | gas |  R = 20.8 R = 20.8 |
 R = 12.5 R = 12.5 |
||
| Helio | gas | 5.1932 | 20.8 | 12.5 | 9.27e-4 |
| Argón | gas | 0.5203 | 20.8 | 12.5 | 9.28e-4 |
| Gas diatómico (Ideal) | gas | 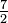 R = 29.1 R = 29.1 |
 R = 20.8 R = 20.8 |
||
| Hidrógeno | gas | 14.30 | 28.82 | 20.4 | 1.29e-3 |
| Nitrógeno | gas | 1.040 | 29.12 | 20.8 | 1.30e-3 |
| Oxígeno | gas | 0.918 | 29.4 | 21.1 | 1.31e-3 |
| Aire (en condiciones típicas de habitación) | gas | 1.012 | 29.19 | ||
| Aluminio | sólido | 0.897 | 24.2 | 2.422 | |
| Amoníaco | líquido | 4.700 | 80.08 | 3.263 | |
| Antimonio | sólido | 0.207 | 25.2 | 1.386 | |
| Arsénico | sólido | 0.328 | 24.6 | 1.878 | |
| Berilio | sólido | 1.82 | 16.4 | 3.367 | |
| Carbono (diamante) | sólido | 0.519 | |||
| Carbono (grafito) | sólido | 0.711 | |||
| Cobre | sólido | 0.385 | 24.47 | 3.45 | |
| Diamante | sólido | 0.5091 | 6.115 | 1.782 | |
| Etanol | líquido | 2.44 | 112 | 1.925 | |
| Gasolina | líquido | 2.22 | 228 | ||
| Oro | sólido | 0.1291 | 25.42 | 2.492 | |
| Plata | sólido | 0.237 | 25.56 | ||
| Grafito | sólido | 0.710 | 8.53 | 1.534 | |
| Hierro dulce | sólido | 0.450 | 25.1 | 3.537 | |
| Níquel | sólido | 0.444 | |||
| Plomo | sólido | 0.129 | 26.4 | 1.44 | |
| Wolframio | sólido | 0.133 | |||
| Titanio | sólido | 0.523 | |||
| Litio | sólido | 3.58 | 24.8 | 1.912 | |
| Magnesio | sólido | 1.02 | 24.9 | 1.773 | |
| Mercurio | líquido | 0.1395 | 27.98 | 1.888 | |
| Neón | gas | 1.0301 | 20.7862 | 12.4717 | |
| cera de parafina | sólido | 2.5 | 900 | 2.325 | |
| Sílice (fundido) | sólido | 0.703 | 42.2 | 1.547 | |
| Uranio | sólido | 0.116 | 27.7 | 2.216 | |
| Agua | gas (100 °C) | 2.080 | 37.47 | 28.03 | |
| Agua | líquido (25 °C) | 4.1813 | 75.327 | 74.53 | 4.184 |
| Agua | sólido (0 °C) | 2.050 | 38.09 | 2.100 | |
| Alúmina Al2O3 | sólido | 0.160 | |||
| MgO | sólido | 0.457 | |||
| SiC | sólido | 0.344 | |||
| Nylon 66 | sólido | 1.20-2.09 | |||
| Fenólicos | sólido | 1.40-1.67 | |||
| Polietileno (AD) | sólido | 1.92-2.30 | |||
| Polipropileno | sólido | 1.880 | |||
| Politetrafluoretileno | sólido | 1.050 | |||
| Todas las medidas son a 25 °C a menos que se indique lo contrario, Los mínimos y máximos notables se muestran en negrita. |
|||||
Materiales de Construcción y su Calor Específico
Estos datos son útiles para entender cómo el calor afecta los materiales usados en edificios:
| Sustancia | Estado de agregación | cp J·g−1·K−1 |
|---|---|---|
| Asfalto | sólido | 0.92 |
| Ladrillo | sólido | 0.84 |
| Hormigón | sólido | 0.88 |
| Vidrio, sílice | sólido | 0.84 |
| Vidrio, crown | sólido | 0.67 |
| Vidrio, flint | sólido | 0.503 |
| Vidrio, pyrex | sólido | 0.876 |
| Granito | sólido | 0.790 |
| Yeso | sólido | 1.09 |
| Mármol, mica | sólido | 0.880 |
| Arena | sólido | 0.835 |
| Suelo | sólido | 0.80 |
| Madera | sólido | 0.49 |
Véase también
 En inglés: Heat capacity Facts for Kids
En inglés: Heat capacity Facts for Kids
- Calor latente
- Almacenamiento de calor
- Calor sensible
- Entalpía
- Agitación térmica