Elementos del bloque d para niños
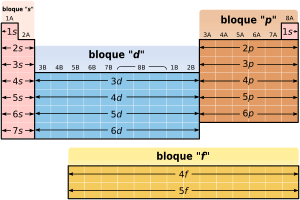
Los elementos del bloque d son un grupo especial de elementos químicos que se encuentran en el centro de la tabla periódica de los elementos. Imagina la tabla periódica como un gran mapa de todos los elementos; el bloque d ocupa la parte central, específicamente desde el grupo 3 hasta el grupo 12.
Estos elementos se llaman "bloque d" porque sus electrones más externos, que son los que determinan cómo reaccionan los elementos, se encuentran en un tipo de espacio llamado orbital d. Es como si tuvieran una "dirección" específica para sus electrones.
En el bloque d hay muchos elementos, aunque los más conocidos y estudiados son unos treinta que se encuentran de forma natural. Estos elementos están organizados en diez columnas, llamadas grupos. Dentro de cada grupo, los elementos tienen propiedades físicas y químicas muy parecidas. Sin embargo, los dos elementos de abajo en cada grupo suelen ser más parecidos entre sí que con el elemento de arriba.
Contenido
¿Qué elementos forman el bloque d?
Los elementos del bloque d incluyen metales muy conocidos y útiles en nuestra vida diaria. Aquí tienes una lista de algunos de ellos:
| Z | Nombre | Símbolo |
|---|---|---|
| 21 | Escandio | Sc |
| 22 | Titanio | Ti |
| 23 | Vanadio | V |
| 24 | Cromo | Cr |
| 25 | Manganeso | Mn |
| 26 | Hierro | Fe |
| 27 | Cobalto | Co |
| 28 | Níquel | Ni |
| 29 | Cobre | Cu |
| 30 | Zinc | Zn |
| 39 | Itrio | Y |
| 40 | Circonio | Zr |
| 41 | Niobio | Nb |
| 42 | Molibdeno | Mo |
| 43 | Tecnecio | Tc |
| 44 | Rutenio | Ru |
| 45 | Rodio | Rh |
| 46 | Paladio | Pd |
| 47 | Plata | Ag |
| 48 | Cadmio | Cd |
| 71 | Lutecio | Lu |
| 72 | Hafnio | Hf |
| 73 | Tantalio | Ta |
| 74 | Wolframio | W |
| 75 | Renio | Re |
| 76 | Osmio | Os |
| 77 | Iridio | Ir |
| 78 | Platino | Pt |
| 79 | Oro | Au |
| 80 | Mercurio | Hg |
| 103 | Lawrencio | Lr |
| 104 | Rutherfordio | Rf |
| 105 | Dubnio | Db |
| 106 | Seaborgio | Sg |
| 107 | Bohrio | Bh |
| 108 | Hasio | Hs |
| 109 | Meitnerio | Mt |
| 110 | Darmstadtio | Ds |
| 111 | Roentgenio | Rg |
| 112 | Copernicio | Cn |
¿Cómo se clasificaron los elementos en el pasado?
Antes de que tuviéramos la tabla periódica moderna, los científicos intentaban encontrar formas de organizar los elementos. Uno de los primeros intentos importantes fue la Ley de las Tríadas, propuesta por Johann Dobereiner en 1817.
La Ley de las Tríadas de Dobereiner
Dobereiner notó algo interesante: algunos grupos de tres elementos (llamados "tríadas") tenían propiedades químicas similares. Además, el peso del elemento del medio era casi el promedio de los pesos de los otros dos.
Por ejemplo, descubrió que el estroncio tenía un peso atómico que era la media entre el calcio y el bario. Estos tres elementos también compartían propiedades químicas.
Otros descubrimientos de tríadas
En 1829, Dobereiner encontró más tríadas, como el cloro, bromo y yodo, o el litio, sodio y potasio. Esta idea de las tríadas se hizo muy popular entre los científicos de la época.
Entre 1829 y 1858, otros investigadores como Jean Baptiste Dumas y Leopold Gmelin, encontraron que estas relaciones no siempre se limitaban a grupos de tres. Por ejemplo, el flúor se añadió al grupo de los halógenos (cloro, bromo, yodo). También se agruparon elementos como el oxígeno, azufre, selenio y teluro en una familia, y el nitrógeno, fósforo, arsénico, antimonio y bismuto en otra.
En ese tiempo, era difícil encontrar patrones perfectos porque no siempre se conocían los pesos atómicos exactos de todos los elementos. A pesar de esto, estos primeros intentos fueron muy importantes para el desarrollo de la tabla periódica que conocemos hoy.
Galería de imágenes
Véase también
 En inglés: D-block Facts for Kids
En inglés: D-block Facts for Kids