Corrosión para niños
La corrosión es el desgaste o daño que sufre un material, como un metal, debido a una reacción química con su entorno. Imagina que los materiales siempre buscan volver a su estado más estable, como cuando se encuentran en la naturaleza. Cuando la corrosión ocurre por una reacción electroquímica (que involucra electricidad y química), su velocidad puede depender de la temperatura, la cantidad de sal en el líquido que toca el metal y las características del metal. Otros materiales, que no son metales, también pueden corroerse de diferentes maneras. Es un proceso natural que ocurre por sí solo.
La corrosión es una reacción química donde participan tres cosas: el objeto fabricado, el ambiente y el agua. A veces, también puede ser una reacción electroquímica.
Los ejemplos más conocidos son los cambios químicos que sufren los metales por el aire. Por ejemplo, el hierro y el acero se cubren de herrumbre (óxido). El cobre y sus aleaciones, como el bronce o el latón, forman una capa verde llamada pátina.
La corrosión es un gran desafío para la industria. Puede causar accidentes si una pieza se rompe. Además, cuesta mucho dinero. Se calcula que cada pocos segundos, una gran cantidad de acero se disuelve en el mundo. Aunque sea invisible en cada pieza, al sumar todo el acero que existe, la cantidad es enorme.
La corrosión es un tema importante en las ciencias de materiales. Combina conocimientos de química y física.
Contenido
¿Qué es la corrosión y cómo funciona?
Lo que causa la corrosión es un movimiento de partículas debido a diferencias químicas entre los materiales. Es un fenómeno electroquímico. Una corriente de electrones se forma cuando hay una diferencia de potencial (como una pequeña batería) entre dos puntos. Cuando una sustancia química cede electrones a otra, la que los cede se llama ánodo y sufre oxidación. La que recibe los electrones se llama cátodo y sufre reducción.
Para que esto suceda, debe haber una diferencia electroquímica. Si unimos dos sustancias con diferentes potenciales, se forma una "pila electroquímica". La sustancia que tiene un potencial de reducción más positivo se reduce. La que tiene un potencial de reducción más negativo se oxida.
Este par de metales forma lo que se conoce como una pila galvánica. En esta pila, la sustancia que se oxida (el ánodo) entrega sus electrones. La sustancia que se reduce (el cátodo) los acepta.
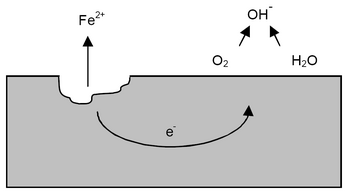
La corrosión de los metales es un proceso natural. La mayoría de los metales no son estables en su forma pura. Por ejemplo, el oro es una excepción. Los metales se encuentran en la Tierra como óxidos, dentro de minerales. Desde hace mucho tiempo, las personas han transformado estos óxidos en metal puro. La corrosión es, en realidad, el regreso del metal a su estado natural, el óxido.
A menudo escuchamos hablar del acero inoxidable:
- Este tipo de acero contiene al menos un 11% de cromo. El cromo lo hace resistente al óxido cuando está expuesto al oxígeno.
- Hay muchas variedades de aceros "inoxidables", con nombres como "304" o "316N". Cada uno tiene una composición y tratamientos diferentes. Cada tipo de acero es adecuado para ciertos ambientes.
¿Cuáles son los tipos de corrosión?

Existen muchas formas en que ocurre la corrosión. Principalmente, es un proceso electroquímico.
Corrosión química
En la corrosión química, un material se disuelve en un líquido que lo daña. Se seguirá disolviendo hasta que se consuma por completo o el líquido ya no pueda disolver más.
Las aleaciones de cobre, como el bronce, desarrollan una capa verde. Esto se debe a la formación de carbonato e hidróxidos de cobre. Por eso, la Estatua de la Libertad tiene ese color verdoso.
Algunos líquidos que causan corrosión son: ácido clorhídrico, ácido sulfúrico (hasta cierta concentración) y ácido fluorhídrico.
Ataque por metal líquido
Los metales líquidos pueden dañar a los metales sólidos en sus puntos más débiles. Esto puede generar grietas con el tiempo.
Disolución selectiva
Esto ocurre cuando se separan partes de una aleación. Por ejemplo, en el hierro fundido gris, el hierro se disuelve en agua o tierra. Esto deja escamas de grafito y causa fugas o fallas en las tuberías.
Disolución de materiales cerámicos
Los materiales cerámicos que se usan para contener metal fundido pueden disolverse por las sustancias que se forman en la superficie del metal.
Ataque químico a los plásticos
Los plásticos suelen ser resistentes a la corrosión. Por ejemplo, el teflón es muy resistente. Estos materiales soportan muchos ácidos y líquidos. Sin embargo, algunos líquidos pueden dañar los plásticos. Sus moléculas pequeñas pueden separar las cadenas de los plásticos, causando que se hinchen y se agrieten. Líquidos como el benceno y el tolueno pueden corroer plásticos como el polietileno. Por eso, estos líquidos deben guardarse en envases de metal o vidrio.
Tipos de corrosión electroquímica
Corrosión por contacto de metales diferentes
Esto sucede cuando dos metales o aleaciones diferentes, como el cobre y el hierro, se unen y forman una pequeña batería. También se le llama corrosión por depósito o en grietas. Ocurre en pequeños espacios donde dos piezas de metal (iguales o diferentes) o un metal y un material no metálico se tocan. La corrosión se acumula más rápido en las grietas y hendiduras de una estructura.
Corrosión por esfuerzo
Este tipo de corrosión ocurre por la acción de una pequeña corriente eléctrica. También puede suceder si hay impurezas en el extremo de una grieta. La pieza falla debido a la corrosión y a una fuerza aplicada. Cuanto mayor sea la fuerza, menos tiempo tardará en fallar.
Corrosión por oxígeno
Esta corrosión suele ocurrir en superficies expuestas al oxígeno diatómico disuelto en agua o al aire. Las altas temperaturas y la presión elevada, como en las calderas de vapor, la favorecen. En las máquinas que usan vapor, la corrosión reduce su eficiencia y vida útil.
Corrosión por microorganismos
Es un tipo de corrosión electroquímica. Algunos microorganismos pueden causar corrosión en superficies metálicas sumergidas. Esto incluye bacterias, algas y hongos. Algunas bacterias usan el hidrógeno disuelto en el agua, creando una diferencia de potencial. Su acción se asocia con la formación de pequeños agujeros o la presencia de ácido sulfhídrico. Es esencial que haya agua en el ambiente.
Corrosión por diferencias de oxígeno
Si el oxígeno en una tubería, por ejemplo, tiene diferentes presiones en distintos puntos, una parte de la superficie estará más aireada que otra. Esto forma una pequeña batería. El área con menos oxígeno actúa como ánodo (se oxida) y la que tiene más oxígeno actúa como cátodo (se reduce). Los electrones se mueven y se forma óxido en una parte. Este tipo de corrosión es común en superficies irregulares donde el oxígeno no llega por igual.
Corrosión galvánica
Es la más común. Ocurre cuando dos metales diferentes actúan como ánodo y cátodo. El metal con el potencial de reducción más negativo se oxida. El metal con el potencial de reducción más positivo se reduce. Este par de metales forma una pila galvánica. El metal que se oxida (ánodo) cede sus electrones, y el metal que se reduce (cátodo) los acepta.
Corrosión por material no uniforme
Se produce en aleaciones metálicas debido a imperfecciones en la mezcla de los metales.
Corrosión por aireación superficial
También conocido como efecto Evans. Ocurre en superficies planas, en lugares húmedos y con suciedad. La suciedad, junto con la humedad, crea un ambiente más cargado negativamente.
Ejemplos de corrosión en la vida diaria
Lavadora automática
A veces, la corrosión es evidente. Pero en una lavadora, podemos darnos cuenta de un problema de corrosión por ruidos extraños. Al revisar el tambor, podríamos encontrar una grieta. Aunque el tambor sea de acero inoxidable, puede sufrir un tipo de corrosión llamado corrosión fisurante. Este tipo de corrosión es difícil de detectar hasta que la pieza falla.
Construcciones de concreto
En construcciones de concreto como los puentes, podemos ver los efectos de la corrosión por manchas de herrumbre en la superficie. Otros ejemplos son estacionamientos subterráneos o postes de electricidad. Estas estructuras tienen varillas de acero por dentro, cubiertas de concreto.
El concreto es una mezcla que, por su alto valor de pH, es compatible con el acero. Sin embargo, el concreto tiene poros por donde el oxígeno y el agua del ambiente pueden entrar. Esto inicia la corrosión de las varillas de acero. Si la estructura de concreto está en contacto frecuente con agua salada (como el agua de mar), los iones de cloruro pueden llegar a las varillas a través de la porosidad del concreto. La herrumbre que se forma reduce el tamaño de la varilla y hace que pierda su agarre con el concreto.
A medida que la corrosión avanza, aparecen grietas en el concreto y luego manchas en la superficie. Esto no solo ocurre cerca del mar. También sucede en ciudades industrializadas debido al dióxido de azufre de las fábricas y los escapes de los autos.
Envases metálicos para conservas
Si guardamos latas de conserva por mucho tiempo, podemos notar que se abomban y pierden su brillo. Esta deformación se debe a la acumulación de gas hidrógeno y es una señal de corrosión extrema. Indica que la conserva ya no es segura para consumir.
Los materiales más comunes para las latas son el aluminio, la hojalata y la chapa cromada. La hojalata sigue siendo la más usada.
La corrosión de la hojalata por los alimentos envasados es un proceso electroquímico. La hojalata tiene varias capas que, al contacto con el alimento (que actúa como un líquido conductor), forman una pila galvánica. La soldadura de la lata también contribuye a la corrosión.
¿Cómo proteger los materiales de la corrosión?
Diseño
El diseño de las estructuras es importante. Se puede planificar para aislar las superficies del ambiente.
Recubrimientos
Se usan capas protectoras para aislar las zonas que se oxidan y las que se reducen. Esto impide que el oxígeno o el vapor de agua lleguen al metal y causen corrosión. Por ejemplo, la pintura evita que el metal se oxide.
Elección del material
La primera idea es elegir un material que no se corroa en el ambiente donde se usará. Se pueden usar aceros inoxidables, aluminios, cerámicas o plásticos. La elección también debe considerar otros factores, como el peso de la pieza, su resistencia al calor o si conduce electricidad.
Es importante recordar que ningún material es completamente inoxidable. Incluso el aluminio puede corroerse.
Al diseñar, hay que evitar zonas cerradas, el contacto entre materiales diferentes y las imperfecciones en general. También hay que considerar la importancia de la corrosión y cuándo será necesario reemplazar la pieza (mantenimiento preventivo).
Control del ambiente
Cuando se trabaja en un ambiente cerrado (como un circuito de agua), se pueden controlar los factores que influyen en la corrosión. Esto incluye la composición química (especialmente la acidez), la temperatura y la presión. Se pueden añadir productos llamados "inhibidores de corrosión". Un inhibidor de corrosión es una sustancia que, al añadirse a un líquido, reduce mucho la velocidad de la corrosión. El tipo de inhibidor depende del metal y del ambiente. Un inhibidor que funciona bien en un sistema podría incluso acelerar la corrosión en otro.
Inhibidores de la corrosión
Los inhibidores de corrosión son productos que actúan formando capas protectoras sobre la superficie del metal. También pueden entregar sus electrones al medio. Se usan en sistemas de enfriamiento como radiadores, torres de enfriamiento y calderas.
Métodos preventivos de protección
Antes de aplicar una protección, hay que preparar la superficie del metal. Esto significa limpiarla y quitarle cualquier material extraño. También se pueden añadir sustancias que eviten el paso del oxígeno o el agua. Por ejemplo, la pintura impide que la corrosión avance.
Véase también
 En inglés: Corrosion Facts for Kids
En inglés: Corrosion Facts for Kids
- Corrosión galvánica
- Corrosión por erosión
- Pintura anticorrosiva
- Sustancia corrosiva
- Protección catódica