Hierro para niños
Datos para niños Manganeso ← Hierro → Cobalto |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Hierro, Fe, 26 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Metales de transición | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 8, 4, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 55,847 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Ar] 3d6 4s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Mohs | 5,0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones por nivel | 2, 8, 14, 2 (imagen) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | Metálico brillante con un tono gris | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio medio | 140 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 1,83 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico (calc) | 155.8 pm (radio de Bohr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 126 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio de van der Waals | Sin datos pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | 2, 3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Óxido | Anfótero | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª energía de ionización | 762,5 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.ª energía de ionización | 1561,9 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3.ª energía de ionización | 2957 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4.ª energía de ionización | 5290 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líneas espectrales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Sólido (ferromagnético) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | 7874 kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 1808 K (1535 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | 3023 K (2750 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de vaporización | 349,6 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | 13,8 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión de vapor | 7,05 Pa a 1808 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto crítico | 204 K (−69 °C) 50 Pa |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volumen molar | 17 m3/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | Cúbica centrada en el cuerpo | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor específico | 440 J/(kg·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad eléctrica | 9,93·106 S/m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 80,2 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Resistencia máxima | 540 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo elástico | 200 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de cizalladura | 73 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido | 4910 m/s a 293,15 K (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del hierro | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

El hierro es un elemento químico con el número atómico 26. Se encuentra en el grupo 8, periodo 4 de la tabla periódica de los elementos. Su símbolo es Fe, que viene del latín fĕrrum. Su masa atómica es de 55,847 u.
Este metal de transición es el cuarto elemento más común en la corteza terrestre, formando un 5% de ella. Entre los metales, solo el aluminio es más abundante. Es el metal más abundante en masa en todo el planeta. Esto se debe a que el núcleo de la Tierra tiene una gran cantidad de hierro y níquel en estado metálico. El movimiento de estos metales genera el campo magnético de la Tierra.
El hierro ha sido muy importante a lo largo de la historia. Incluso hay un periodo histórico llamado la Edad de Hierro. En el Universo, el hierro es un metal especial. Es el metal más pesado que se puede crear por fusión nuclear en el centro de estrellas masivas. Los elementos más pesados que el hierro solo se forman en supernovas.
Contenido
¿Qué es el Hierro?
El hierro es un metal que se puede moldear fácilmente. Tiene un color gris plateado y es ferromagnético a temperatura ambiente. Esto significa que es atraído por los imanes. Es un metal muy duro y denso.
En la naturaleza, el hierro se encuentra en muchos minerales, especialmente en forma de óxido. Rara vez se encuentra solo. Para obtener hierro puro, se extrae de sus óxidos usando carbono. Luego se refina para quitarle las impurezas.
El hierro-56 es el isótopo más estable de este elemento. Esto se debe a que su núcleo tiene la mayor energía de enlace por nucleón.
El hierro puede tener diferentes formas según la temperatura y la presión. A presión normal, estas formas son:
- Hierro-α: Es estable hasta los 911 °C. Su estructura es cúbica centrada en el cuerpo (BCC).
- Hierro-γ: Se encuentra entre 911 °C y 1392 °C. Tiene una estructura cúbica centrada en las caras (FCC).
- Hierro-δ: De 1392 °C a 1539 °C, vuelve a tener una estructura cúbica centrada en el cuerpo.
- Hierro-ε: Puede aparecer a altas presiones con una estructura hexagonal compacta (HCP).
¿Para qué se usa el Hierro?
El hierro es el metal duro más utilizado en el mundo. Representa el 95% de la producción mundial de metales. El hierro puro no se usa mucho, excepto por sus propiedades magnéticas. Su mayor uso es para crear productos siderúrgicos. En estos productos, el hierro se mezcla con otros elementos para obtener materiales con diferentes propiedades.
Una mezcla de hierro se llama acero si tiene menos del 2,1% de carbono. Si tiene más carbono, se llama fundición. El acero es muy importante por su bajo costo y su resistencia. Se usa en automóviles, barcos y en las estructuras de los edificios.
Las mezclas de hierro tienen muchas propiedades mecánicas. Estas propiedades cambian según su composición y cómo se procesan.
Tipos de Aceros
Acero Los aceros son mezclas de hierro con un máximo de 2% de carbono. El carbono puede estar disuelto en el hierro o formar carburo de hierro. Algunos aceros no son ferromagnéticas. También pueden contener otros elementos y impurezas.
Los aceros se clasifican por su contenido de carbono:
- Acero bajo en carbono: Contiene menos del 0,25% de carbono. Son blandos pero flexibles. Se usan en vehículos, tuberías y estructuras. También hay aceros de alta resistencia con otros elementos, que son fáciles de trabajar.
- Acero medio en carbono: Contiene entre 0,25% y 0,6% de carbono. Se tratan con calor para mejorar sus propiedades. Son más resistentes que los aceros bajos en carbono, pero menos flexibles. Se usan en piezas de ingeniería que necesitan mucha resistencia.
- Acero alto en carbono: Contiene entre 0,60% y 1,4% de carbono. Son muy resistentes, pero menos flexibles. Se les añaden otros elementos para formar carburos muy duros, como el carburo de wolframio. Estos aceros se usan principalmente en herramientas.
- Aceros aleados: Los aceros sin otros elementos no siempre cumplen las necesidades de la industria. Para obtener características especiales como resistencia al desgaste, dureza o resistencia a altas temperaturas, se usan aceros aleados. Se añaden uno o varios elementos para cambiar sus propiedades químicas y estructurales.
Los aceros al carbono (sin alear) se clasifican por su contenido de carbono:
- Aceros hipoeutectoides: Con 0.02% a 0,8% de carbono.
- Aceros eutectoides: Con 0,8% de carbono.
- Aceros hipereutectoides: Con 0,8% a 2% de carbono.
Aceros inoxidables: El hierro se oxida fácilmente. Para evitarlo, se le añade un 12% de cromo. El cromo forma una capa protectora de óxido de cromo en la superficie. Esto protege al acero de la corrosión. A veces se añade níquel para evitar que se formen carburos de cromo, que pueden hacer el acero frágil.
El hierro se usa mucho para hacer aceros estructurales. También se usa para producir hierro fundido y hierro forjado. Otros usos del hierro y sus compuestos incluyen la fabricación de imanes, tintes y abrasivos.
El hierro se obtiene en un alto horno. Los minerales de hierro se calientan con coque (un tipo de carbón) para reducir los óxidos. Los elementos no deseados como fósforo, azufre y manganeso se separan con piedra caliza.
Los gases del alto horno contienen óxido de carbono. La escoria se forma cuando la piedra caliza reacciona con otros componentes. Si la escoria se enfría en agua, puede producir monóxido de carbono y sulfuro de hidrógeno. Los líquidos de desecho del proceso de hierro pueden tener muchas partículas y compuestos orgánicos, amoníaco, arsénico y sulfuros.
Tipos de Fundiciones
Cuando una mezcla de hierro tiene más de 1.73% de carbono, se llama fundición. El carbono puede estar disuelto o en forma libre. Las fundiciones son muy duras pero frágiles. Hay varios tipos:
- Gris
- Blanca
- Atruchada
- Maleable americana
- Maleable europea
- Esferoidal o dúctil
- Vermicular
Cada tipo de fundición tiene características diferentes y se usa en distintas aplicaciones. Por ejemplo, se usan en motores, válvulas y engranajes.
Los óxidos de hierro también tienen muchos usos. Se usan en pinturas, para obtener hierro, y la magnetita (Fe3O4) y el óxido de hierro (III) (Fe2O3) se usan en aplicaciones magnéticas. El hidróxido de hierro (III) (Fe(OH)3) se usa en radioquímica para concentrar ciertos elementos.
Historia del Hierro
Se cree que el hierro se usó por primera vez hace más de 4000 años, por los sumerios y egipcios.
Entre el 2000 y 1000 a.C., se encontraron más objetos de hierro en Mesopotamia, Anatolia y Egipto. Al principio, el hierro era muy valioso, incluso más que el oro, y se usaba en ceremonias. Algunos piensan que se obtenía como un subproducto al hacer cobre.
Entre 1600 a.C. y 1200 a.C., el uso del hierro creció en Oriente Medio, pero el bronce seguía siendo el metal principal.
Entre los siglos XII y X a.C., hubo un cambio rápido en Oriente Medio de armas de bronce a armas de hierro. Esto pudo deberse a la falta de estaño, más que a una mejora en la forma de trabajar el hierro. A este periodo se le llama la Edad de Hierro, que siguió a la Edad de Bronce. En Grecia, el hierro se empezó a usar alrededor del año 1000 a.C. y llegó a Europa occidental en el siglo VII a.C. Fue un cambio lento porque era difícil fabricar objetos de hierro.
En Europa Central, la cultura de Hallstatt surgió en el siglo IX a.C. Esta cultura se considera la "primera Edad de Hierro" en la región. Hacia el 450 a.C., se desarrolló la cultura de La Tène, también llamada "segunda Edad de Hierro". El hierro se usaba para herramientas, armas y joyas, aunque el bronce seguía siendo común.
Durante esta transición, se descubrió la "carburización". Este proceso consiste en añadir carbono al hierro. El hierro se calentaba con carbón vegetal y luego se enfriaba en agua o aceite. El resultado era un material más duro y menos frágil que el bronce, al que empezó a reemplazar.
En China, el primer hierro también vino de meteoritos. Se encontraron objetos de hierro forjado del siglo VIII a.C. en el noroeste. El proceso era similar al de Oriente Medio y Europa. A finales de la dinastía Zhou (550 a.C.), se logró obtener hierro colado. El mineral de hierro en China tenía mucho fósforo, lo que permitía fundirlo a temperaturas más bajas. Sin embargo, no fue muy usado hasta la dinastía Qing (hacia 221 a.C.).
En Europa, el hierro colado tardó más en aparecer porque no se alcanzaban las temperaturas necesarias. Las primeras muestras de hierro colado en Europa se encontraron en Suecia, de los años 1150 a 1350.
En la Edad Media y hasta finales del siglo XIX, muchos países europeos usaban la farga catalana para producir hierro y acero. Este sistema usaba carbón vegetal y mineral de hierro, alcanzando hasta 1200 °C. Fue reemplazado por los altos hornos.
Al principio, se usaba carbón vegetal para obtener hierro. En el siglo XVIII, en Inglaterra, el carbón vegetal escaseó. Entonces, se empezó a usar coque, un combustible fósil. Abraham Darby fue el primero en usar coque en un "alto horno" a principios del siglo XVIII. El coque también fue una fuente de energía clave en la Revolución industrial, cuando la demanda de hierro creció mucho, por ejemplo, para los ferrocarriles.
El alto horno mejoró con el tiempo. Henry Cort introdujo nuevas técnicas en 1784. A finales del siglo XVIII y principios del XIX, el hierro se usó mucho en estructuras como puentes y edificios. El primer puente de hierro fundido se construyó entre 1776 y 1779. En Inglaterra, el hierro se usó por primera vez en edificios a principios del siglo XIX. Obras famosas como el Palacio de Cristal (1851) y la Torre Eiffel (1889) son ejemplos del uso masivo del hierro en la construcción.
¿Dónde se encuentra y cómo se obtiene el Hierro?
El hierro es el metal de transición más común en la corteza terrestre y el cuarto elemento más abundante en general. También se encuentra en el Universo, incluso en meteoritos. Es el metal principal que forma el núcleo de la Tierra, con hasta un 70%. Se encuentra en muchos minerales, como la hematites (Fe2O3), la magnetita (Fe3O4), la limonita (FeO (OH)), la siderita (FeCO3), la pirita (FeS2) y la ilmenita (FeTiO3).
El hierro se obtiene de sus óxidos, que pueden tener más o menos impurezas. Muchos minerales de hierro son óxidos, y los que no, se pueden convertir en óxidos.
La extracción del hierro de sus óxidos se hace en un horno especial llamado alto horno. Allí se mezclan los minerales de hierro con coque y carbonato de calcio (CaCO3), que ayuda a separar las impurezas.
Dentro del horno, ocurren varias reacciones químicas. El carbono reacciona con el oxígeno para formar dióxido de carbono:
- <chem>C + O2 -> CO2</chem>
El dióxido de carbono puede convertirse en monóxido de carbono:
- <chem>CO2 + C -> 2CO</chem>
El proceso de quemar coque con oxígeno libera energía, calentando el horno hasta 1900 °C en la parte inferior.
Los óxidos de hierro se reducen con monóxido de carbono, por ejemplo:
- <chem>Fe3O4 + CO -> 3FeO + CO2</chem>
- <chem>FeO + CO -> Fe + CO2</chem>
A medida que se desciende en el horno y la temperatura sube, los óxidos reaccionan con el coque (carbono), reduciéndose. Por ejemplo:
- <chem>Fe3O4 + C -> 3FeO + CO</chem>
El carbonato de calcio se descompone:
- <chem>CaCO3 -> CaO + CO2</chem>
Y el dióxido de carbono se convierte en monóxido de carbono con el coque.
Al final, se producen procesos de carburación:
- <chem>3Fe + 2CO -> Fe3C + CO2</chem>
Finalmente, se quema y se elimina el azufre con la entrada de aire. Se obtienen dos productos: la escoria y el arrabio. El arrabio es hierro fundido y es la materia prima para la industria.
El arrabio suele tener impurezas. Por eso, se refina en hornos llamados "convertidores".
En el año 2000, los mayores productores de hierro eran China, Brasil, Australia, Rusia e India. Juntos producían el 70% del hierro mundial. Actualmente, el yacimiento de hierro más grande del mundo está en El Mutún, Bolivia. Se estima que tiene entre 40.000 y 42.000 millones de toneladas, lo que representa el 40% de las reservas mundiales.
Producción Mundial de Hierro
Aquí se muestra la producción mundial de mineral de hierro en 2024, en millones de toneladas por año:
| Puesto | País | Millones de toneladas |
|---|---|---|
| 1 | 930 | |
| 2 | 440 | |
| 3 | 270 | |
| 4 | 270 | |
| 5 | 91 | |
| 6 | 90 | |
| 7 | 66 | |
| 8 | 54 | |
| 9 | 48 | |
| 10 | 42 | |
| 11 | 30 | |
| 12 | 28 | |
| 13 | 21 | |
| 14 | 18 | |
| 15 | 18 | |
| Otros | 87 |
Compuestos del Hierro
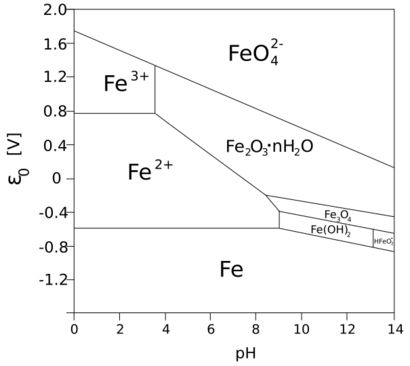
Categoría:Compuestos de hierro Los estados de oxidación más comunes del hierro son +2 y +3. Los óxidos de hierro más conocidos son el óxido de hierro (II) (FeO), el óxido de hierro (III) (Fe2O3) y el óxido mixto (Fe3O4). El hierro también forma muchas sales y compuestos en estos estados. El hexacianoferrato (II) de hierro (III), usado en pinturas, se conoce como azul de Prusia.
Se conocen algunos compuestos con estados de oxidación +4, +5 y +6, pero son menos comunes. El ferrato de potasio (K2FeO4), con hierro en estado +6, se usa como oxidante. El estado +4 se encuentra en pocos compuestos y en algunos procesos biológicos.
Algunos compuestos de hierro tienen estados de oxidación inusuales. Por ejemplo, el tetracarbonilferrato disódico, Na2[Fe(CO)4], donde el hierro tiene un estado de oxidación de –2.
El Fe3C se llama cementita, que contiene 6,67% de carbono. El hierro α se conoce como ferrita. La mezcla de ferrita y cementita se llama perlita o ledeburita, según el carbono. La austenita es una solución de carbono en hierro γ (Gamma).
El Hierro en los Seres Vivos
Metabolismo humano del hierro Aunque el hierro está en pequeñas cantidades en los seres vivos, es muy importante para su crecimiento y supervivencia. Es necesario para que los tejidos reciban suficiente oxígeno y para el metabolismo de la mayoría de las células.
Hoy en día, con más oxígeno en la atmósfera, el hierro en el ambiente se encuentra casi siempre en forma oxidada (férrica, Fe3+). En esta forma, no es fácil de usar por los organismos.
En adultos sanos, el cuerpo tiene entre 2 y 4 gramos de hierro. Se distribuye de dos maneras:
70% como hierro funcional (2,8 de 4 gramos):
- En los Eritrocitos (glóbulos rojos) (65%).
- En los tejidos: mioglobinas (4%).
- En enzimas que dependen del hierro (1%).
Estas enzimas son vitales para las mitocondrias y controlan la oxidación dentro de las células.
Transferrina (0,1%): Esta proteína transporta el hierro.
La mayor parte del hierro funcional está en los glóbulos rojos.
30% como hierro de depósito (1 gramo):
- Ferritina (2/3): Es la forma principal de almacenar hierro en los tejidos.
- Hemosiderina (1/3).
- Hemoglobina: Transporta el oxígeno a las células.
- Transferrina: Transporta el hierro en la sangre.
El hierro de los alimentos se absorbe de dos formas. El hierro "hem" (de la hemoglobina y mioglobina, presente en la carne) se absorbe muy bien. El hierro "no hem" (la mayor parte del hierro en la dieta) se absorbe peor.
La absorción del hierro hem no se ve afectada por la dieta. Se absorbe directamente. El hierro se libera dentro de las células del intestino.
La absorción del hierro "no hem" sí se ve afectada por muchos factores de la dieta. El hierro "no hem" de los alimentos es hierro férrico. Debe convertirse en hierro ferroso en el estómago antes de ser absorbido en el duodeno.
Otros factores que influyen en la absorción del hierro son:
- La cantidad de hierro almacenado en el cuerpo. Si hay mucho hierro, se absorbe menos. Este es el principal control.
- La producción de glóbulos rojos en la médula ósea. Si la producción disminuye, la absorción de hierro también baja.
La absorción del hierro ferroso ocurre en el duodeno y la parte superior del yeyuno. Es un proceso activo que necesita energía. El hierro se une a proteínas especiales en las células intestinales. Luego se dirige a otras partes de la célula para formar ferritina y pasar a la sangre.
La mucosa intestinal regula la absorción del hierro. Esto evita que se acumule demasiado hierro en el cuerpo. La absorción también depende de la cantidad de ferritina en las células intestinales.
El hierro está en casi todos los seres vivos y tiene muchas funciones:
- Muchas proteínas contienen el grupo hemo. Este grupo tiene un átomo de hierro. Ejemplos:
- La hemoglobina transporta oxígeno, y la mioglobina lo almacena.
- Los citocromos ayudan en la respiración celular y en la eliminación de sustancias.
- Las peroxidasas y catalasas eliminan sustancias tóxicas llamadas peróxidos.
- Las proteínas de hierro/azufre (Fe/S) participan en el transporte de electrones.
- También hay proteínas con átomos de hierro unidos por oxígeno (Fe-O-Fe). Ejemplos:
Los animales usan transferrinas para transportar el hierro en el cuerpo. Para almacenarlo, usan ferritina y hemosiderina. El hierro entra al cuerpo por el intestino delgado y es transportado o almacenado. La mayor parte del hierro se reutiliza y muy poco se elimina.
Tanto el exceso como la falta de hierro pueden causar problemas de salud. El exceso de hierro puede ocurrir por tomar demasiados suplementos.
La hemocromatosis es una enfermedad genética. Causa una absorción excesiva de hierro, que se acumula en el hígado. Esto puede dañar el hígado.
En las transfusiones de sangre, se usan sustancias que se unen al hierro. Esto evita que haya demasiado hierro libre en el cuerpo. Estas sustancias se llaman sideróforos. Muchos microorganismos usan sideróforos para obtener el hierro que necesitan. También se pueden usar como antibióticos, ya que impiden que el hierro esté disponible para las bacterias.
Isótopos del Hierro
El hierro tiene cuatro isótopos estables naturales: 54Fe, 56Fe, 57Fe y 58Fe. Sus cantidades en la naturaleza son:
- 54Fe: 5,85%
- 56Fe: 91,75%
- 57Fe: 2,12%
- 58Fe: 0,28%
Cuidado con el Hierro
La siderosis es la acumulación de hierro en los tejidos. El exceso de hierro puede ser perjudicial para el organismo. El hierro puede reaccionar y producir "radicales libres", que son moléculas que pueden dañar las células. La reacción más importante es:
- <chem>Fe^{2+}{}+ H2O2 -> Fe^{3+}{}+ OH- + OH.</chem>
Cuando los niveles de hierro son normales, el cuerpo tiene formas de controlar este proceso. Sin embargo, si hay demasiado hierro, estos mecanismos pueden no ser suficientes.
El exceso de hierro puede acumularse en el hígado y dañarlo. Es importante que los niveles de hierro en el cuerpo estén equilibrados.
El hierro es muy beneficioso para el cuerpo humano, ya que el cuerpo no puede crearlo por sí mismo.
Ver también
- Metabolismo humano del hierro
- Bronce
- Forja
- Forja catalana
- Hierro forjado
- Hojalata
- Metalurgia
- Agente quelante
- Siderurgia
Véase también
 En inglés: Iron Facts for Kids
En inglés: Iron Facts for Kids