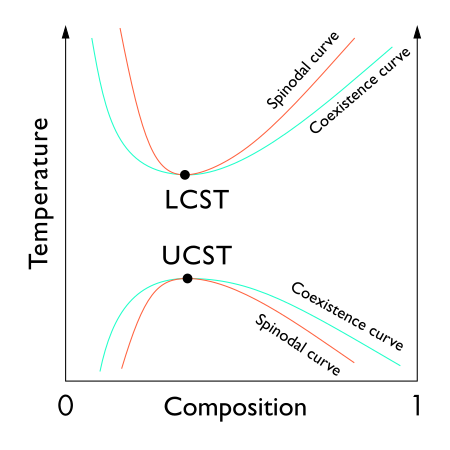Punto crítico (termodinámica) para niños
Un punto crítico es un concepto importante en la termodinámica y la fisicoquímica. Imagina que tienes un líquido y su vapor (gas) en un recipiente cerrado. Si aumentas la temperatura y la presión, el líquido se vuelve menos denso y el vapor se vuelve más denso. Llega un momento en que las densidades del líquido y del vapor se vuelven iguales. En ese punto, ya no puedes distinguir entre el líquido y el vapor; se convierten en una sola sustancia. Ese es el punto crítico.
En el punto crítico, el volumen de un líquido es igual al de una masa igual de vapor. Esto significa que las propiedades del líquido y del vapor se vuelven idénticas.
Contenido
¿Qué es el Punto Crítico Líquido-Vapor?
El punto crítico líquido-vapor es el tipo de punto crítico más conocido. Se refiere al momento en que un líquido y su vapor se unen en una sola fase.
Entendiendo el Diagrama de Fases
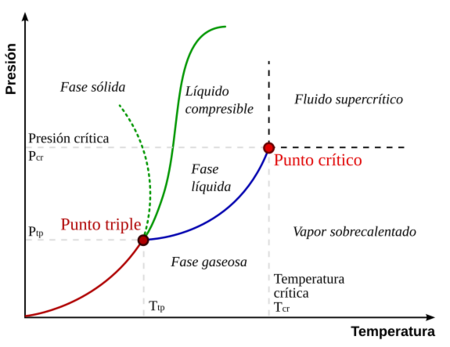
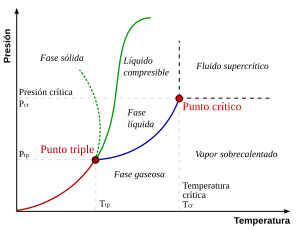
Un diagrama de fases es como un mapa que muestra los diferentes estados (sólido, líquido, gas) de una sustancia según la presión y la temperatura. En este mapa, las líneas separan las fases donde dos estados pueden coexistir. Por ejemplo, la línea entre el líquido y el vapor muestra las condiciones en las que el líquido hierve o el vapor se condensa.
El punto crítico es el final de la línea que separa el líquido del vapor. Más allá de este punto, no hay una distinción clara entre el líquido y el vapor.
El Punto Crítico del Agua
Para el agua, el punto crítico se alcanza a una temperatura de 373.946 °C y una presión de 22.064 megapascales (que es como 217.75 veces la presión atmosférica normal). ¡Imagina lo caliente y presurizado que debe estar!
Cambios Cerca del Punto Crítico
Cuando una sustancia se acerca a su punto crítico, sus propiedades cambian mucho. Por ejemplo, el agua líquida normalmente no se puede comprimir fácilmente y no se expande mucho con el calor. Pero cerca de su punto crítico, el agua se vuelve muy compresible y se expande mucho. También cambia su capacidad para disolver otras sustancias.
En el punto crítico, el calor necesario para convertir el líquido en vapor (llamado calor de vaporización) es cero, porque ya no hay una diferencia entre ellos.
¿Qué es un Fluido Supercrítico?
Por encima del punto crítico, la sustancia se encuentra en un estado llamado fluido supercrítico. Este fluido no es ni un líquido ni un gas, sino algo intermedio. Puede fluir como un gas, pero también puede disolver cosas como un líquido. Los científicos Michael Fisher y Benjamin Widom han estudiado mucho este estado.
Historia del Descubrimiento

La existencia de un punto crítico fue descubierta por primera vez por Charles Cagniard de la Tour en 1822. Más tarde, fue nombrado por Dmitri Mendeleev en 1860 y estudiado por Thomas Andrews en 1869.
Cagniard demostró que el Dióxido de carbono (CO2) podía convertirse en líquido a 31 °C si la presión era de 73 atmósferas. Sin embargo, si la temperatura era un poco más alta, el CO2 no se convertía en líquido, incluso si la presión aumentaba muchísimo. Esto mostró que había un límite de temperatura para que una sustancia pudiera ser líquida.
Ejemplos de Puntos Críticos
Aquí tienes una tabla con las temperaturas y presiones críticas de algunas sustancias comunes:
| Sustancia | Temperatura crítica | Presión crítica (absoluta) |
|---|---|---|
| Argón | −122,4 °C (150,8 K) | 48,1 atm (4873,7 kPa) |
| Amoniaco (NH3) | 132,4 °C (405,6 K) | 111,3 atm (11 277,5 kPa) |
| 1,1,1,2-Tetrafluoroetano (R-134a) | 101,06 °C (374,2 K) | 40,06 atm (4059,1 kPa) |
| R-410A | 72,8 °C (346 K) | 47,08 atm (4770,4 kPa) |
| Bromo | 310,8 °C (584 K) | 102 atm (10 335,2 kPa) |
| Cesio | 1664,85 °C (1938,0 K) | 94 atm (9524,6 kPa) |
| Cloro | 143,8 °C (417 K) | 76 atm (7700,7 kPa) |
| Etanol (C2H5OH) | 241 °C (514,2 K) | 62,18 atm (6300,4 kPa) |
| Flúor | −128,85 °C (144,3 K) | 51,5 atm (5218,3 kPa) |
| Helio | −267,96 °C (5,2 K) | 2,24 atm (227 kPa) |
| Hidrógeno | −239,95 °C (33,2 K) | 12,8 atm (1297,0 kPa) |
| Kriptón | −63,8 °C (209,4 K) | 54,3 atm (5502,0 kPa) |
| Metano (CH4) | −82,3 °C (190,9 K) | 45,79 atm (4639,7 kPa) |
| Neón | −228,75 °C (44,4 K) | 27,2 atm (2756,0 kPa) |
| Nitrógeno | −146,9 °C (126,3 K) | 33,5 atm (3394,4 kPa) |
| Oxígeno (O2) | −118,6 °C (154,6 K) | 49,8 atm (5046,0 kPa) |
| Dióxido de carbono (CO2) | 31,04 °C (304,2 K) | 72,8 atm (7376,5 kPa) |
| Óxido nitroso (N2O) | 36,4 °C (309,6 K) | 71,5 atm (7244,8 kPa) |
| Ácido sulfúrico (H2SO4) | 654 °C (927,2 K) | 45,4 atm (4600,2 kPa) |
| Xenon | 16,6 °C (289,8 K) | 57,6 atm (5836,3 kPa) |
| Litio | 2950 °C (3223,2 K) | 652 atm (66 064,1 kPa) |
| Mercurio | 1476,9 °C (1750,1 K) | 1720 atm (174 279,5 kPa) |
| Azufre | 1040,85 °C (1314,0 K) | 207 atm (20 974,3 kPa) |
| Hierro | 8227 °C (8500,2 K) | |
| Oro | 6977 °C (7250,2 K) | 5000 atm (506 626,4 kPa) |
| Aluminio | 7577 °C (7850,2 K) | |
| Agua (H2O) | 373,946 °C (647,1 K) | 217,7 atm (22 058,5 kPa) |
Punto Crítico Líquido-Líquido en Mezclas
Las mezclas de líquidos también pueden tener puntos críticos. Esto ocurre cuando dos líquidos que normalmente no se mezclan bien (como el aceite y el agua) se vuelven una sola fase a una cierta temperatura y presión.
Existen dos tipos principales de puntos críticos líquido-líquido:
- Temperatura Crítica Superior de la Solución (UCST): Es la temperatura más alta a la que, si enfrías la mezcla, los dos líquidos se separan.
- Temperatura Crítica Inferior de la Solución (LCST): Es la temperatura más baja a la que, si calientas la mezcla, los dos líquidos se separan.
Véase también
 En inglés: Critical point (thermodynamics) Facts for Kids
En inglés: Critical point (thermodynamics) Facts for Kids
- Fluido supercrítico
- Punto de ebullición
- Punto de fusión
- Punto triple
- Teoría de las catástrofes
- Anexo:Punto crítico de los elementos químicos