Mioglobina para niños
Datos para niños Mioglobina |
||||||
|---|---|---|---|---|---|---|
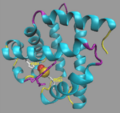
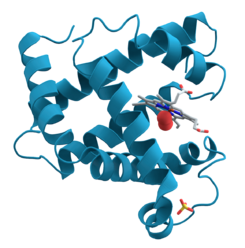 Modelo mostrando la conformación helicoidal (hélices alfa) de la cadena polipeptídica en la mioglobina.
|
||||||
| Estructuras disponibles | ||||||
| PDB |
Buscar ortólogos: PDBe, RCSB Lista de códigos PDB
3RGK
|
|||||
| Identificadores | ||||||
| Símbolos | MB (HGNC: 6915) PVALB | |||||
| Identificadores externos |
||||||
| Locus | Cr. 22 q11.2-ter | |||||
|
||||||
| Ortólogos | ||||||
| Especies |
|
|||||
| Entrez |
|
|||||
| Ensembl |
|
|||||
| UniProt |
|
|||||
| RefSeq (ARNm) |
|
|||||
| RefSeq (proteína) NCBI |
|
|||||
| Ubicación (UCSC) |
|
|||||
| PubMed (Búsqueda) |
|
|||||
La Mioglobina es una proteína especial que se encuentra en nuestros músculos. Su trabajo principal es guardar oxígeno para que los músculos puedan usarlo cuando lo necesiten. Es muy parecida a la hemoglobina, que es la proteína que transporta oxígeno en la sangre.
La mioglobina está hecha de una cadena de 153 aminoácidos y tiene una parte llamada grupo hemo. Este grupo hemo contiene un átomo de hierro, que es clave para que la mioglobina pueda unirse al oxígeno.
Las mayores cantidades de mioglobina se encuentran en los músculos que usamos para movernos (músculo esquelético) y en el músculo cardíaco (el corazón). Esto es porque estos músculos necesitan mucho oxígeno para funcionar bien y contraerse.
Contenido
Descubrimiento de la Mioglobina
La mioglobina fue la primera proteína de la que se pudo conocer su forma tridimensional exacta. Esto fue un gran avance en la ciencia.
¿Quién la descubrió?
En 1958, un científico llamado John Kendrew y su equipo lograron determinar la estructura de la mioglobina. Usaron una técnica especial llamada cristalografía de rayos X.
Premio Nobel
Gracias a este importante descubrimiento, John Kendrew recibió el Premio Nobel de Química en 1962. Compartió este premio con otro científico, Max Perutz.
Estructura de la Mioglobina
La mioglobina tiene una forma muy compacta y redonda, como una pequeña bola.
Partes de su estructura
- La mayoría de sus aminoácidos que "odian" el agua (hidrófobos) se esconden en el interior de la proteína.
- Los aminoácidos que "aman" el agua (polares) están en la superficie, en contacto con el agua.
- Casi el 78% de su estructura tiene una forma de espiral, como un muelle, llamada hélice alfa. Tiene ocho de estas espirales, que se nombran con las letras de la A a la H.
El grupo hemo
Dentro de la mioglobina hay un espacio donde se guarda el grupo hemo. Esta parte no es una proteína, pero es esencial para que la mioglobina pueda unirse al oxígeno. El grupo hemo está unido a la mioglobina de forma especial y le da su característico color rojo.
¿Cómo funciona la Mioglobina?
La mioglobina y la hemoglobina son proteínas que usan el grupo hemo para transportar y guardar oxígeno.
El papel del hierro
En el centro del grupo hemo hay un átomo de hierro. Este hierro es el que se une al oxígeno. Cuando el oxígeno se une a la mioglobina, el átomo de hierro se mueve un poco.
Liberación de oxígeno
Este pequeño movimiento del hierro hace que la forma de la proteína cambie ligeramente. Este cambio ayuda a que la mioglobina libere el oxígeno en las células de los músculos que más lo necesitan. Así, los músculos tienen la energía necesaria para funcionar, especialmente durante el ejercicio.
Mioglobina vs. Hemoglobina
Aunque son parecidas, la mioglobina y la hemoglobina tienen una diferencia importante en cómo se unen al oxígeno:
- La mioglobina se une al oxígeno de una manera sencilla.
- La hemoglobina, en cambio, es una proteína más compleja. Cuando una parte de la hemoglobina se une al oxígeno, esto ayuda a que otras partes se unan al oxígeno más fácilmente. A esto se le llama unión "cooperativa".
Véase también
 En inglés: Myoglobin Facts for Kids
En inglés: Myoglobin Facts for Kids
Galería de imágenes
-
La proteína mioglobina, descrita en primer lugar en 1973 por H.C. Watson y John Kendrew.(PDB-ID: 1MNB) En esta representación de la estructura observamos un claro predominio de las estructuras secundarias α-hélice, concretamente 8 segmentos (representadas en cian) unidas mediante giros (violeta). El grupo prostético hemo o tetrapirrol cíclico (magenta) se asocia de manera no covalente a la hendidura hidrofóbica que se forma entre la hélices E y F cuando la proteína adopta su conformación nativa. En el centro de este anillo existe un hierro ferroso (Fe+2, en color ocre) que se coordina con los 4 átomos de nitrógeno de la porfirina, un N de la cadena lateral de la histidina proximal F8 (His93) y como 6.º ligando un grupo hidroxilo (OH, oxígeno en rojo), cerca del cual observamos la histidina distal (His93).