Hemoglobina para niños
Datos para niños Hemoglobina, alfa 1 |
||||||
|---|---|---|---|---|---|---|
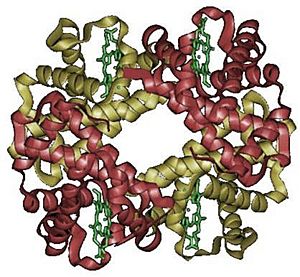
 Modelo de tipo mixto del dímero de hemoglobina humana con una cadena A como boceto en el frente, y la cadena B por detrás como palos; hemoglobina y en el centro como bolas rojas.
|
||||||
| Estructuras disponibles | ||||||
| PDB | Buscar ortólogos: PDBe, RCSB | |||||
| Identificadores | ||||||
| Símbolo | HBA1 (HGNC: 4823) | |||||
| Identificadores externos |
||||||
| Locus | Cr. 16 p13.3 | |||||
|
||||||
| Ortólogos | ||||||
| Especies |
|
|||||
| Entrez |
|
|||||
| UniProt |
|
|||||
| RefSeq (ARNm) |
|
|||||
La hemoglobina es una proteína muy importante que se encuentra en la sangre. Es de color rojo y es la responsable de que tu sangre tenga ese color. Su trabajo principal es llevar el oxígeno desde tus pulmones a todas las partes de tu cuerpo. También ayuda a transportar una parte del dióxido de carbono de vuelta a los pulmones para que lo expulses. Además, la hemoglobina ayuda a mantener el equilibrio del pH en la sangre, lo cual es muy importante para que tu cuerpo funcione bien.
La hemoglobina está formada por cuatro partes más pequeñas, llamadas subunidades. Cada una de estas subunidades tiene un grupo especial llamado "hemo".
Contenido
Descubriendo la Hemoglobina: Un Viaje Histórico
En 1824, un científico llamado J.F. Engelhard notó que la cantidad de hierro en la hemoglobina era la misma en diferentes animales. Usando el peso del hierro, calculó que la hemoglobina era una molécula muy grande. Al principio, otros científicos no lo creyeron, ¡les parecía demasiado grande! Pero en 1925, Gilbert Smithson Adair confirmó sus hallazgos.
El médico y químico alemán Friedrich Ludwig Hünefeld descubrió la hemoglobina en 1840. Años después, en 1851, Otto Funke describió cómo hacer crecer cristales de hemoglobina. Luego, Felix Hoppe-Seyler explicó cómo la hemoglobina puede tomar y soltar oxígeno.
En 1959, Max Perutz logró ver la estructura de una proteína parecida a la hemoglobina, llamada mioglobina, usando una técnica especial con rayos X. Por este gran descubrimiento, ganó el Premio Nobel de Química en 1962. El fisiólogo francés Claude Bernard fue quien explicó cómo funciona la hemoglobina en la sangre.
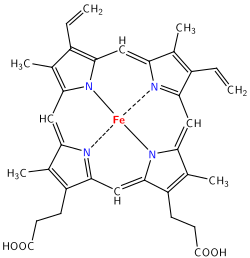
El nombre "hemoglobina" viene de "heme" y "globina". "Heme" se refiere al grupo que contiene hierro, y "globina" a la parte de la proteína globular. Cada grupo hemo tiene un átomo de hierro que puede unirse a una molécula de oxígeno.
¿Cómo es la Estructura de la Hemoglobina?
| hemoglobina, alfa 2 | ||||||
|---|---|---|---|---|---|---|
| Estructuras disponibles | ||||||
| PDB | Buscar ortólogos: PDBe, RCSB | |||||
| Identificadores | ||||||
| Símbolo | HBA2 (HGNC: 4824) | |||||
| Identificadores externos |
||||||
| Locus | Cr. 16 p13.3 | |||||
|
||||||
| Ortólogos | ||||||
| Especies |
|
|||||
| Entrez |
|
|||||
| UniProt |
|
|||||
| RefSeq (ARNm) |
|
|||||
| hemoglobina, beta | ||||||
|---|---|---|---|---|---|---|
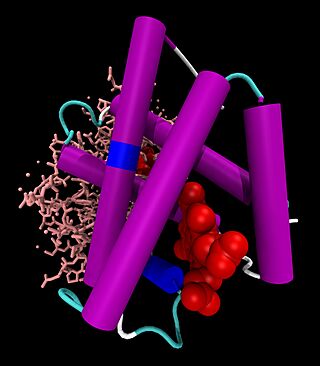
 Modelo de barras y esferas de hemo de la cadena de hemoglobina B, con hemo cargado; el Fe como bola VDW verde, dioxígeno detrás, después de dPDB 1GZX.
|
||||||
| Estructuras disponibles | ||||||
| PDB | Buscar ortólogos: PDBe, RCSB | |||||
| Identificadores | ||||||
| Símbolo | HBB (HGNC: 4827) | |||||
| Identificadores externos |
||||||
| Locus | Cr. 11 p15.5 | |||||
|
||||||
| Ortólogos | ||||||
| Especies |
|
|||||
| Entrez |
|
|||||
| UniProt |
|
|||||
| RefSeq (ARNm) |
|
|||||
La hemoglobina está hecha de cuatro cadenas de proteínas llamadas globinas. Cada una de estas cadenas tiene un grupo hemo. El átomo de hierro en el grupo hemo es el que puede unirse al oxígeno y luego soltarlo.
El grupo hemo se forma en varios pasos:
- Primero, una molécula llamada succinil-CoA se une a un aminoácido llamado glicina. Esto forma un grupo pirrol.
- Luego, cuatro grupos pirrol se unen para formar la protoporfirina IX.
- Finalmente, la protoporfirina IX se une a un ion de hierro (Fe2+), formando el grupo hemo.
La hemoglobina en los adultos (HbA) tiene dos tipos de cadenas: dos cadenas alfa y dos cadenas beta. La cadena alfa tiene 141 aminoácidos, y la cadena beta tiene 146 aminoácidos. Cada una de estas cadenas está unida a un grupo hemo. Las cuatro subunidades de la hemoglobina se unen para formar una estructura con forma de tetraedro.
El grupo hemo se encuentra en un espacio dentro de la cadena de globina y está protegido. El átomo de hierro en el centro del grupo hemo es clave para unirse al oxígeno.
¿Cómo se Une el Oxígeno a la Hemoglobina?
La forma en que el oxígeno se une a la hemoglobina se puede ver en una gráfica llamada "curva de unión del oxígeno". Esta curva muestra cuánta hemoglobina está "llena" de oxígeno. Cuando la hemoglobina se une a una molécula de oxígeno, es más fácil que se unan más moléculas de oxígeno. Y cuando suelta una molécula de oxígeno, es más fácil que suelte las demás. A esto se le llama comportamiento cooperativo.
Este comportamiento cooperativo es muy importante para que la hemoglobina transporte el oxígeno de manera eficiente. En tus pulmones, la hemoglobina se llena casi por completo de oxígeno (un 98%). Cuando viaja por la sangre y llega a los tejidos que necesitan oxígeno, suelta gran parte de ese oxígeno (alrededor del 66%). Si la hemoglobina no tuviera este comportamiento cooperativo, no sería tan buena transportando oxígeno.
La hemoglobina en los bebés (HbF) es diferente a la de los adultos (HbA). La HbF tiene una mayor capacidad para unirse al oxígeno. Esto es importante para que el bebé pueda tomar oxígeno de la sangre de su madre antes de nacer. Después del nacimiento, la hemoglobina del bebé cambia a la de adulto.
Cuando la hemoglobina se une al oxígeno, cambia de forma. Pasa de un estado "tenso" (llamado estado T) a un estado "relajado" (llamado estado R). Este cambio de forma ayuda a que la hemoglobina sea más eficiente para tomar y soltar oxígeno.
Oxihemoglobina: La Hemoglobina con Oxígeno

Cuando la hemoglobina tiene oxígeno unido, se llama oxihemoglobina. Esta es la que le da el color rojo brillante a la sangre que va por tus arterias. Cuando la hemoglobina suelta el oxígeno, se llama desoxihemoglobina y tiene un color rojo más oscuro, como la sangre de tus venas.
La unión del oxígeno a la hemoglobina ocurre en varios pasos:
- Hb + O2 ↔ HbO2
- HbO2 + O2 ↔ Hb(O2)2
- Hb(O2)2 + O2 ↔ Hb(O2)3
- Hb(O2)3 + O2 ↔ Hb(O2)4
La reacción completa es:
- Hb + 4 O2 → Hb(O2)4
Factores que Afectan a la Hemoglobina
El 2,3-bisfosfoglicerato (2,3-BPG)
Dentro de tus glóbulos rojos, hay una sustancia llamada 2,3-bisfosfoglicerato (2,3-BPG). Esta sustancia es muy importante porque ayuda a la hemoglobina a soltar el oxígeno en los tejidos. El 2,3-BPG se une a la hemoglobina cuando está en su estado "tenso" (estado T), haciendo que sea más difícil que el oxígeno se una. Esto asegura que la hemoglobina no se aferre demasiado al oxígeno y lo libere donde se necesita.
El Efecto Bohr: pH y Dióxido de Carbono
El efecto Bohr explica cómo el pH (la acidez) y la cantidad de dióxido de carbono en la sangre afectan la capacidad de la hemoglobina para transportar oxígeno. Cuando tus músculos están trabajando mucho, producen más dióxido de carbono y la sangre se vuelve un poco más ácida (el pH baja). La hemoglobina detecta estos cambios y suelta más oxígeno justo donde se necesita.
Por ejemplo, en los pulmones, donde hay mucho oxígeno y el pH es normal, la hemoglobina toma mucho oxígeno. Pero en un músculo activo, donde hay menos oxígeno y el pH es más bajo, la hemoglobina suelta más oxígeno.
La hemoglobina también ayuda a transportar una parte del dióxido de carbono de vuelta a los pulmones. Además, actúa como un "amortiguador" para mantener el pH de la sangre estable.
Importancia de la Hemoglobina para tu Salud
Cuando tu cuerpo no recibe suficiente oxígeno, se estimula la producción de 2,3-BPG en tus glóbulos rojos. Esto ayuda a que la hemoglobina libere más oxígeno.
- Hipoxia: Si hay poco oxígeno en el cuerpo (hipoxia), aumenta el 2,3-BPG para que la hemoglobina suelte más oxígeno. Es una forma en que tu cuerpo se adapta.
- Anemia: Es una condición donde hay poca hemoglobina en la sangre. Esto significa que no llega suficiente oxígeno a los tejidos. En la anemia, el 2,3-BPG también aumenta para ayudar a liberar más oxígeno.
- Adaptación a la altura: Las personas que viven en lugares altos, donde hay menos oxígeno en el aire, desarrollan más 2,3-BPG y otros cambios para que su cuerpo funcione bien.
Diferentes Tipos de Hemoglobina
Existen varios tipos de hemoglobina, cada uno con una estructura ligeramente diferente:
- Hemoglobina A (HbA): Es la hemoglobina más común en los adultos, representando cerca del 97%. Tiene dos cadenas alfa y dos cadenas beta.
- Hemoglobina A2: Es un tipo menos común en adultos (menos del 2.5%). Tiene dos cadenas alfa y dos cadenas delta.
- Hemoglobina S: Es una hemoglobina diferente que se encuentra en personas con una condición llamada anemia de células falciformes.
- Hemoglobina F (HbF): Es la hemoglobina que tienen los bebés antes de nacer. Tiene dos cadenas alfa y dos cadenas gamma. Después del nacimiento, se reemplaza por la HbA.
- Oxihemoglobina: Es la hemoglobina que lleva oxígeno.
- Metahemoglobina: Es un tipo de hemoglobina donde el hierro no puede unirse al oxígeno. Puede ser causada por una enfermedad o por ciertas sustancias.
- Carbaminohemoglobina: Es la hemoglobina que transporta dióxido de carbono.
- Carboxihemoglobina: Es la hemoglobina que se une al monóxido de carbono. El monóxido de carbono se une a la hemoglobina mucho más fuerte que el oxígeno, lo cual es muy peligroso.
- Hemoglobina glicada: Es hemoglobina unida a glucosa. Aunque es normal tener un poco, niveles altos pueden indicar problemas de salud como la diabetes.
También existen hemoglobinas como Gower 1, Gower 2 y Hemoglobina Portland, que solo se encuentran en el embrión.
Véase también
 En inglés: Hemoglobin Facts for Kids
En inglés: Hemoglobin Facts for Kids