Óxido para niños
Un óxido es un compuesto químico muy común. Se forma cuando un átomo de oxígeno se une con un átomo de casi cualquier otro elemento químico. El oxígeno en los óxidos suele tener una carga especial de -2.
Existen muchísimos tipos de óxidos. Los podemos encontrar en los tres estados de la materia: sólido, líquido y gas, incluso a temperatura ambiente. Casi todos los elementos pueden formar óxidos estables. Por eso, sus propiedades son muy variadas.
La mayoría de los óxidos se pueden clasificar en dos grandes grupos: ácidos o básicos. Esto depende de si forman ácidos o bases cuando se mezclan con agua.
Un óxido básico se forma cuando el oxígeno se une a un metal. Por ejemplo, el óxido que se forma en el hierro cuando se oxida es un óxido básico. Un óxido ácido se forma cuando el oxígeno reacciona con un no metal.
Por ejemplo, el óxido nítrico (NO) o el dióxido de nitrógeno (NO2) son óxidos. Los óxidos son muy abundantes en la corteza terrestre. Los óxidos no metálicos también se conocen como anhídridos. Esto es porque pueden formarse al quitar una molécula de agua de otros compuestos.
Por ejemplo, si el dióxido de carbono (<chem>CO2</chem>) se hidrata en ciertas condiciones, puede formar ácido carbónico:
- <chem>CO2 + H2O = H2CO3</chem>
Los óxidos se pueden crear directamente mediante procesos de oxidación. Por ejemplo, los óxidos básicos se forman con elementos metálicos como el magnesio:
- <chem>2Mg + O2 = 2 MgO</chem>
Y los óxidos ácidos se forman con elementos no metálicos, como el fósforo:
- <chem>P4 + 5O2 = 2 P2O5</chem>
Contenido
Óxidos: ¿Qué son y cómo se forman?
Los óxidos son compuestos muy diversos. Se forman por la combinación de oxígeno con otro elemento. La forma en que se unen y la cantidad de átomos de cada elemento pueden variar mucho. Por ejemplo, el monóxido de carbono (CO) y el dióxido de carbono (CO2) son dos óxidos diferentes del mismo elemento, el carbono.
Existen óxidos "binarios", que solo tienen oxígeno y otro elemento. Pero también hay óxidos más complejos. Estos pueden incluir otros elementos o iones. Un ejemplo es el silicato de hierro, Fe2SiO4, que es un óxido con tres elementos.
¿Cómo se nombran los óxidos?
Los óxidos se pueden nombrar de varias maneras, dependiendo de la cantidad de átomos o de la carga del elemento que se une al oxígeno.
Nomenclatura sistemática (por cantidad de átomos)
Esta forma de nombrar los óxidos se basa en cuántos átomos de oxígeno hay. Se usan prefijos griegos:
- Un oxígeno: óxido o monóxido
- Dos oxígenos: dióxido
- Tres oxígenos: trióxido
- Cuatro oxígenos: tetraóxido
Y así sucesivamente.
Nomenclatura Stock (por número de oxidación)
En esta nomenclatura, se indica la carga o "número de oxidación" del elemento que se une al oxígeno. Se usan números romanos entre paréntesis.
- <chem>N2O</chem> = Óxido de nitrógeno (I)
- <chem>FeO</chem> = Óxido de hierro (II)
- <chem>Fe2O3</chem> = Óxido de hierro (III)
- <chem>Cl2O</chem> = Óxido de cloro (I)
- <chem>Cl2O3</chem> = Óxido de cloro (III)
- <chem>Cl2O5</chem> = Óxido de cloro (V)
- <chem>Cl2O7</chem> = Óxido de cloro (VII)
Nomenclatura tradicional (histórica)
Esta nomenclatura usa prefijos y sufijos especiales. El sufijo "-oso" se usa para la carga más baja del metal. El sufijo "-ico" se usa para la carga más alta. Para algunos elementos con muchas cargas, se usan "hipo-" y "per-".
- <chem>FeO</chem> --> Óxido ferroso (hierro con carga +2)
- <chem>Fe2O3</chem> --> Óxido férrico (hierro con carga +3)
- <chem>Cl2O</chem> --> Óxido hipocloroso (cloro con carga +1)
- <chem>Cl2O3</chem> --> Óxido cloroso (cloro con carga +3)
- <chem>Cl2O5</chem> --> Óxido clórico (cloro con carga +5)
- <chem>Cl2O7</chem> --> Óxido perclórico (cloro con carga +7)
Tipos especiales de óxidos
Además de los óxidos comunes, existen otros tipos como los peróxidos y los superóxidos. Estos tienen el oxígeno con cargas diferentes y reaccionan de maneras distintas.
También se habla de "protóxido". Es un nombre para los óxidos comunes donde el oxígeno tiene su carga normal de -2. Y el otro elemento tiene su carga más baja posible.
Por ejemplo:
- <chem>H2O2</chem> = Peróxido de hidrógeno
¿Cómo se clasifican los óxidos?
Los óxidos se pueden clasificar según su composición o su comportamiento químico.
Óxidos binarios y mixtos
- Óxidos binarios: Formados solo por oxígeno y otro elemento.
- Óxidos mixtos: Formados por dos elementos diferentes y oxígeno. Un ejemplo son las espinelas.
Óxidos básicos, ácidos y anfóteros
Según cómo reaccionan, hay tres tipos principales:
- Óxidos básicos: Se forman con un metal y oxígeno. Los elementos menos electronegativos (que atraen menos los electrones) tienden a formar óxidos básicos. Antiguamente se les llamaba "anhídridos básicos". Si se les añade agua, pueden formar hidróxidos básicos.
* Ejemplo: <chem>Na2O + H2O = 2Na(OH)</chem>
- Óxidos ácidos: Se forman con un no metal y oxígeno. Los elementos más electronegativos (que atraen más los electrones) tienden a formar óxidos ácidos. Antes se les llamaba "anhídridos ácidos". Si se les añade agua, forman oxácidos.
* Ejemplo: <chem>CO2 + H2O = H2CO3</chem>
- Óxidos anfóteros: Son óxidos especiales que pueden actuar como ácido o como base. Esto depende de con qué otra sustancia reaccionen. No son muy comunes. Suelen tener puntos de fusión bajos. Un ejemplo es el óxido de aluminio (<chem>Al2O3</chem>).
Algunos óxidos no muestran un comportamiento ni ácido ni básico.
¿Dónde encontramos los óxidos?
Los óxidos tienen una gran variedad de estructuras. Pueden ser moléculas individuales o estructuras más grandes y complejas, como los cristales. A temperatura ambiente, pueden ser sólidos, líquidos o gases. Los óxidos sólidos de metales suelen tener estructuras complejas.
Óxidos moleculares (gases)
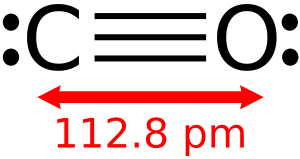

Aunque la mayoría de los óxidos de metales son sólidos, algunos óxidos son moléculas. Esto significa que existen como unidades separadas. Ejemplos de óxidos moleculares son el dióxido de carbono y el monóxido de carbono. Todos los óxidos simples de nitrógeno son moleculares, como el NO, N2O, NO2 y N2O4. El pentóxido de fósforo es un óxido molecular más complejo, cuya fórmula real es P4O10.
¿Cómo reaccionan los óxidos?
Reducción de óxidos
La reducción de un óxido metálico para obtener el metal puro es un proceso muy importante. Se usa a gran escala para producir algunos metales. Muchos óxidos metálicos se convierten en metales simplemente calentándolos. Por ejemplo, el óxido de plata se descompone a 200 °C:
- <chem> 2 Ag2O -> 4 Ag + O2</chem>
Sin embargo, la mayoría de las veces, los óxidos de metales se reducen usando otra sustancia química. Un agente reductor común y económico es el carbono, en forma de coque. El ejemplo más conocido es la fundición del mineral de hierro. Muchas reacciones ocurren, pero la ecuación simplificada es:
- <chem>2 Fe2O3 + 3 C -> 4 Fe + 3 CO2</chem>
Algunos óxidos de metales se disuelven en presencia de sustancias que los reducen. Esto incluye algunos compuestos orgánicos. La disolución de los óxidos férricos es parte de fenómenos geoquímicos como el ciclo del hierro.
Disolución de óxidos
Los enlaces entre el metal y el oxígeno suelen ser muy fuertes. Por eso, los óxidos metálicos no suelen disolverse fácilmente en líquidos. Sin embargo, pueden ser atacados por ácidos y bases en agua.
Cuando los óxidos se disuelven, a menudo forman iones con oxígeno llamados oxianiones. Si se añade una base acuosa a <chem>P4O10</chem>, se forman varios fosfatos. Si se añade una base acuosa a <chem>MoO3</chem>, se forman polioxometalatos.
Galería de imágenes
Véase también
 En inglés: Oxide Facts for Kids
En inglés: Oxide Facts for Kids
- Hidróxido
- Ozónido
- Subóxido





