Isótopo para niños
Se denomina isótopos a los átomos de un mismo elemento que tienen una cantidad diferente de neutrones en su núcleo. Por esta razón, su número másico (el total de protones y neutrones) es distinto.
La palabra isótopo viene del griego y significa "en el mismo lugar". Esto se debe a que todos los isótopos de un mismo elemento químico se encuentran en el mismo sitio en la tabla periódica. Los átomos que son isótopos tienen el mismo número atómico (la cantidad de protones en el núcleo), pero se diferencian en el número de neutrones.
La mayoría de los elementos químicos tienen varios isótopos. Solo 8 elementos, como el berilio o el sodio, tienen un único isótopo natural. En cambio, el estaño es el elemento con más isótopos estables, ¡tiene 10!
Otros elementos tienen isótopos naturales que son inestables, como el uranio. Estos isótopos pueden transformarse en otros más estables, liberando energía en el proceso. Por eso se les llama radiactivos.
Los isótopos inestables son muy útiles para calcular la edad de rocas y materia orgánica. Esto es posible porque se conoce la velocidad a la que se transforman. Gracias a este método, podemos estimar la edad de la Tierra.
| Isótopo | Núcleos por millón |
|---|---|
| Hidrógeno-1 | 705 700 |
| Hidrógeno -2 | 23 |
| Helio-4 | 275 200 |
| Helio-3 | 35 |
| Oxígeno-16 | 5920 |
| Carbono-12 | 3032 |
| Carbono-13 | 37 |
| Neón-20 | 1548 |
| Neón-22 | 208 |
| Hierro-56 | 1169 |
| Hierro-54 | 72 |
| Hierro-57 | 28 |
| Nitrógeno-14 | 1105 |
| Silicio-28 | 653 |
| Silicio-29 | 34 |
| Silicio-30 | 23 |
| Magnesio-24 | 513 |
| Magnesio-26 | 79 |
| Magnesio-25 | 69 |
| Azufre-32 | 39 |
| Argón-36 | 77 |
| Calcio-40 | 60 |
| Aluminio-27 | 58 |
| Níquel-58 | 49 |
| Sodio-23 | 33 |
Contenido
Isótopos: ¿Qué son y para qué sirven?
¿Qué es un isótopo?
Todos los isótopos de un elemento tienen el mismo número atómico, pero se diferencian en su número másico. Esto significa que tienen la misma cantidad de protones, pero distinta cantidad de neutrones.
Si la relación entre protones y neutrones no es la adecuada para que el núcleo sea estable, el isótopo es radiactivo.
Por ejemplo, el carbono en la naturaleza existe como una mezcla de tres isótopos: 12C, 13C y 14C. El carbono-12 es el más común (98.89%), seguido por el carbono-13 (1.11%), y el carbono-14 se encuentra en muy pequeñas cantidades.
Tipos de isótopos: Naturales y Artificiales
Isótopos Naturales
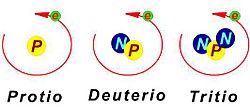
Los isótopos naturales son los que encontramos en la naturaleza. Por ejemplo, el hidrógeno tiene tres isótopos naturales: el protio, el deuterio y el tritio. El tritio se usa mucho en trabajos relacionados con la energía nuclear.
Otro elemento con isótopos muy importantes es el carbono. El carbono-12 es la base para medir el peso de cualquier elemento. El carbono-13 es el único carbono con propiedades magnéticas. El carbono-14 es radiactivo y muy útil en arqueología para saber la edad de fósiles y objetos antiguos, ya que su semivida es de 5730 años. El uranio-235 se usa en las centrales nucleares para generar electricidad.
Isótopos Artificiales
Los isótopos artificiales se crean en laboratorios especiales o en centrales nucleares. Suelen ser inestables y radiactivos, por lo que su vida es corta. Un ejemplo es el cesio, cuyos isótopos artificiales se usan en plantas de energía nuclear. Otro es el iridio-192, que se utiliza para revisar que las soldaduras de tuberías estén bien selladas. Algunos isótopos del uranio, como el uranio-233, también se usan en tecnología nuclear.
Existen menos de 300 isótopos estables y alrededor de 1200 isótopos radiactivos. Algunos isótopos son "casi estables" porque, aunque son radiactivos, tardan muchísimo tiempo en transformarse, mucho más que la edad de la Tierra.
¿Cómo se nombran los isótopos?
Al principio, los isótopos de cada elemento tenían nombres diferentes. Por ejemplo, los tres isótopos del hidrógeno se llamaron protio, deuterio y tritio. El protio tiene un protón, el deuterio un protón y un neutrón, y el tritio un protón y dos neutrones.
Pero como se descubrieron muchísimos isótopos, se cambió el sistema de nombres. Ahora, cada isótopo se representa con el símbolo del elemento. Se le añade un número pequeño arriba a la izquierda que indica su número másico (protones + neutrones). A veces, también se pone un número pequeño abajo a la izquierda que indica el número atómico (solo protones).
Así, los isótopos del hidrógeno se escriben 1
1H, 2
1H y 3
1H. Como todos los isótopos de un mismo elemento tienen el mismo número atómico y símbolo, a menudo se omite el número atómico. Por eso, se suelen ver como 1H, 2H y 3H.
Esto se hace porque los isótopos de un elemento se comportan igual en las reacciones químicas. Por ejemplo, un átomo del isótopo de oxígeno con número másico 18 se unirá a dos átomos de hidrógeno para formar agua, igual que el oxígeno más común con número másico 16. Sin embargo, en reacciones nucleares, es útil incluir el número atómico.
En textos no científicos, como noticias, se usa una forma más sencilla: el nombre del elemento seguido de un guion y el número másico. Así, los isótopos del hidrógeno también se pueden llamar hidrógeno-1, hidrógeno-2 e hidrógeno-3.
Isótopos Radiactivos: Los Radioisótopos
Los radioisótopos son isótopos radiactivos. Tienen un núcleo atómico inestable y liberan energía y partículas al transformarse en un isótopo más estable. Esta transformación se puede detectar con aparatos especiales como un contador Geiger.
¿Por qué son inestables los radioisótopos?
La inestabilidad se debe a un desequilibrio entre la cantidad de protones y neutrones. La fuerza nuclear fuerte mantiene unidos a protones y neutrones. Si hay demasiados neutrones o demasiados protones, esta fuerza no es suficiente para mantener el núcleo estable.
Cuando hay un exceso de neutrones, el átomo puede sufrir un decaimiento beta negativo. Si hay un exceso de protones, puede ocurrir un decaimiento beta positivo. Para elementos con muchos protones (más de 80), también es común la desintegración alfa.
Cada radioisótopo tiene un tiempo característico en el que la mitad de sus átomos se transforman, llamado periodo de semidesintegración o semivida. La energía liberada puede ser en forma de radiación alfa (partículas de helio), beta (partículas de electrones o positrones) o gamma (energía en forma de radiación electromagnética).
Algunos isótopos radiactivos artificiales se usan en medicina para tratamientos como la radioterapia. Por ejemplo, un isótopo del tecnecio (99mTc) puede ayudar a encontrar vasos sanguíneos bloqueados.
Varios isótopos radiactivos naturales se usan en la datación radiométrica para determinar la edad de objetos y eventos, por ejemplo, en arqueología.
Usos de los Isótopos en la Vida Real
Los isótopos tienen muchas aplicaciones en diferentes campos, como la medicina y la industria:
Isótopos en Medicina
- Cobalto-60: Se usaba para tratar el cáncer porque emitía una radiación con mucha energía. Actualmente se usa menos.
- Arsénico-73: Se usa para saber cuánto arsénico ha absorbido el cuerpo. El arsénico-74 ayuda a localizar tumores en el cerebro.
- Fósforo-32: Emite rayos beta y se usa para diagnosticar y tratar enfermedades de los huesos y la médula ósea.
- Yodo-131: Se usa en el tratamiento de algunos tipos de cáncer de tiroides y otras enfermedades de esta glándula.
- Radio-226: Se usa en tratamientos para el cáncer de piel.
- Tritio (3H): Tiene usos médicos como rastreador porque emite electrones de baja energía, que son menos peligrosos que otros tipos de radiación.
- Tecnecio-99: Puede usarse para identificar vasos sanguíneos bloqueados y en medicina nuclear para tratar ciertos tipos de cáncer.
- Lutecio-177: Se usa en medicina nuclear para el tratamiento de cáncer de próstata.
Isótopos en la Industria y la Ciencia
- Bromo-82: Útil para estudiar el movimiento del agua en ríos, lagos y aguas subterráneas, y para detectar fugas en embalses.
- Oro-19: Muy usado en la industria del petróleo para buscar yacimientos y mejorar la extracción.
- Escandio-46: Aplicable en estudios de sedimentología (cómo se forman los sedimentos) y análisis de suelos.
- Lantano-140: Se usa para estudiar el funcionamiento de calderas y hornos industriales.
- Mercurio-197: Se aplica en celdas electrolíticas.
- Nitrógeno-15: Se usa en investigación médica y en agricultura. También en una técnica llamada espectroscopia de resonancia magnética nuclear.
- Oxígeno-18 y deuterio: Estos dos isótopos se usan para saber la temperatura de la Tierra en el pasado.
- Carbono-14: Es muy importante en arqueología para determinar la edad de los fósiles y objetos orgánicos.
- Uranio-235: Se usa en las centrales nucleares para generar energía.
¿Cómo se usan los isótopos para marcar?
En el marcado isotópico, se usan isótopos especiales como "marcadores" en las reacciones químicas. Estos isótopos reaccionan igual que los normales, pero luego se pueden identificar con equipos especiales. Si se usan radioisótopos, también se pueden detectar por la energía que emiten. Separar o "enriquecer" isótopos es un proceso complicado.
Véase también
 En inglés: Isotope Facts for Kids
En inglés: Isotope Facts for Kids
- Tabla de isótopos
- Nucleido
- Isóbaro
- Isótopo estable
- Radioisótopo
- Radioisótopo sintético
- Periodo de semidesintegración
- Radioactividad
Galería de imágenes
-
Algunos isótopos de los elementos níquel (Ni), cobre (Cu) y zinc (Zn). Los elementos se organizan de abajo hacia arriba según su número atómico creciente, y los isótopos de izquierda a derecha según su masa creciente. Color negro: isótopos estables; azul: isótopos emisores de partículas beta negativo; rojo: isótopos emisores de partículas beta positivo.
-
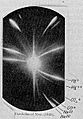
En la esquina inferior derecha de esta placa fotográfica de Joseph John Thomson están marcados los dos isótopos del neón: neón-20 y neón-22.