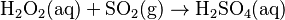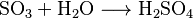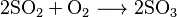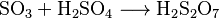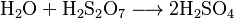Ácido sulfúrico para niños
Datos para niños
Ácido sulfúrico |
||
|---|---|---|
 |
||
 |
||
 |
||
| Nombre IUPAC | ||
| Dihidrogeno(tetraoxidosulfato), dihidroxidodioxidoazufre | ||
| General | ||
| Otros nombres | Tetraoxosulfato(VI) de hidrógeno Aceite de vitriolo Licor de vitriolo Espíritu de vitriolo |
|
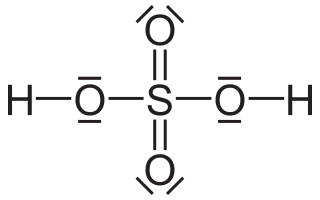
| Fórmula estructural | 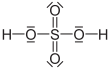 |
|
| Fórmula molecular | H2SO4 | |
| Identificadores | ||
| Número CAS | 7664-93-9 | |
| Número RTECS | WS5600000 | |
| ChEBI | 26836 | |
| ChEMBL | CHEMBL572964 | |
| ChemSpider | 1086 | |
| DrugBank | DB11309 | |
| PubChem | 22066174, 5152822 1118, 22066174, 5152822 | |
| UNII | O40UQP6WCF | |
| KEGG | C00059 D05963, C00059 | |
|
InChI
InChI=InChI=1S/H2O4S/c1-5(2,3)4/h(H2,1,2,3,4)
Key: QAOWNCQODCNURD-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | Líquido aceitoso incoloro | |
| Olor | Inodoro en condiciones normales. Toma un ligero olor picante en caliente. | |
| Densidad | 1840 kg/m³; 1,83 g/cm³ | |
| Masa molar | 98,08 g/mol | |
| Punto de fusión | 283 K (10 °C) | |
| Punto de ebullición | 610 K (337 °C) | |
| Presión de vapor | 0.001 mmHg (20 °C) | |
| Viscosidad | 26.7 cP (20 °C) | |
| Índice de refracción (nD) | 1,397 | |
| Propiedades químicas | ||
| Acidez | −3; 1.99 pKa | |
| Solubilidad en agua | miscible, exotérmico | |
| Termoquímica | ||
| ΔfH0líquido | -814 kJ/mol | |
| S0líquido, 1 bar | 19 J·mol–1·K–1 | |
| Peligrosidad | ||
| SGA |  |
|
| NFPA 704 |
0
3
2
COR
|
|
| Frases H | H314 | |
| Frases P | P260 P264 P280 P301+330+331 P303+361+353 P363 P304+340 P305+351+338 P310 P321 P405 P501 | |
| Riesgos | ||
| Ingestión | Irritación de garganta, erosión dental y estomatitis. Puede destruir la mucosa gástrica y debilitar las paredes del estómago. | |
| Inhalación | Irritación de nariz, bronquitis, enfisema y edema pulmonar | |
| Piel | Irritación, quemaduras de segundo grado y dermatitis | |
| Ojos | Irritación, quemaduras y conjuntivitis | |
| LD50 | 2140 mg/kg (rata, oral) | |
| Más información | [1] | |
| Compuestos relacionados | ||
| Ácidos fuertes | Ácido selénico Ácido clorhídrico Ácido nítrico Ácido crómico. |
|
| Otros ácidos/oxidos | Ácido sulfuroso Ácido peroximonosulfúrico Trióxido de azufre Oleum. |
|
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El ácido sulfúrico es un compuesto químico muy potente, con la fórmula H2SO4. Es uno de los productos químicos más importantes del mundo. Se usa tanto que la cantidad que produce un país puede indicar qué tan desarrollada está su industria.
Una gran parte del ácido sulfúrico se usa para crear ácido fosfórico, que es esencial para producir fertilizantes. Estos fertilizantes ayudan a que las plantas crezcan mejor. También se utiliza para fabricar otros ácidos y sustancias llamadas sulfatos, y es muy importante en la industria petroquímica, que trabaja con productos derivados del petróleo.
Normalmente, el ácido sulfúrico se obtiene a partir de un gas llamado dióxido de azufre. Antiguamente, se le conocía como "aceite de vitriolo" o "espíritu de vitriolo". Estos nombres venían de las sales de sulfato, llamadas "vitriolos", a partir de las cuales se producía.
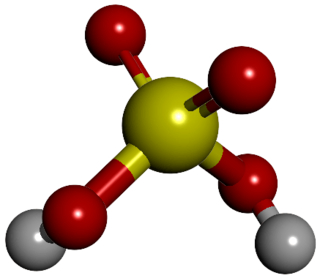
La molécula de ácido sulfúrico tiene una forma piramidal. En el centro está un átomo de azufre, y a su alrededor hay cuatro átomos de oxígeno. Dos átomos de hidrógeno se unen a dos de los átomos de oxígeno. Cuando el ácido sulfúrico se mezcla con agua, se comporta como un ácido fuerte, lo que significa que libera fácilmente sus átomos de hidrógeno.
El ácido sulfúrico tiene una propiedad interesante: puede quitar el agua de otras moléculas, como el azúcar. Si lo pones en azúcar, el ácido absorbe el agua y deja solo el carbono, que se ve como una masa negra.
Contenido
Un Viaje por la Historia del Ácido Sulfúrico
El descubrimiento del ácido sulfúrico se remonta al siglo VII, gracias al alquimista Jabir ibn Hayyan. Más tarde, en el siglo IX, otro alquimista, Ibn Zakariya al-Razi, lo estudió. Él lo obtuvo calentando minerales como el sulfato de hierro (II) y el sulfato de cobre (II) con agua. Al calentarse, estos minerales se descomponían y formaban trióxido de azufre, que al combinarse con agua producía una versión diluida de ácido sulfúrico. Este método llegó a Europa en el siglo XIII a través de traducciones de textos árabes y persas.
Los Primeros Nombres y Usos
Los alquimistas en la Europa medieval llamaban al ácido sulfúrico "aceite de vitriolo" o "licor de vitriolo". La palabra "vitriolo" viene del latín "vitreus", que significa 'cristal', por la apariencia de las sales de sulfato. Algunas de estas sales eran el sulfato de cobre (II) (vitriolo azul) y el sulfato de hierro (II) (vitriolo verde).
El vitriolo era considerado una sustancia muy importante. Se creía que podía ayudar a transformar metales en oro, como parte de la búsqueda de la piedra filosofal. También se usaba para hacer reaccionar otras sustancias.
Avances en Europa y la Producción Industrial
En el siglo XVII, el químico alemán Johann Rudolph Glauber logró producir ácido sulfúrico quemando azufre con nitrato de potasio en presencia de vapor. Este método fue mejorado por Joshua Ward en 1736, quien comenzó a producir ácido sulfúrico en grandes cantidades en Londres.
En 1746, John Roebuck en Birmingham empezó a usar cámaras de plomo para la producción. Estas cámaras eran más resistentes y baratas que las de cristal que se usaban antes. Este "proceso de cámara de plomo" fue un gran paso para la producción industrial de ácido sulfúrico y se usó por más de doscientos años.
Al principio, el ácido obtenido con este método era bastante diluido (entre el 35 % y el 40 %). Con el tiempo, mejoras hechas por Louis Joseph Gay-Lussac y John Glover aumentaron la concentración hasta el 78 %. Sin embargo, para fabricar algunos tintes y otros productos químicos se necesitaba una concentración aún mayor. Esto se lograba con un método más antiguo y costoso, similar al de los alquimistas, que consistía en destilar minerales.
En 1831, Peregrine Phillips patentó un método mucho más económico para obtener ácido sulfúrico concentrado, conocido hoy como el proceso de contacto. Actualmente, la mayor parte del ácido sulfúrico se produce con este método.
¿Cómo se Fabrica el Ácido Sulfúrico?
El ácido sulfúrico se vende en diferentes concentraciones y niveles de pureza. Hay dos métodos principales para producirlo: el método de cámaras de plomo y el proceso de contacto. El método de cámaras de plomo es más antiguo y se usa para el ácido que se emplea en fertilizantes, produciendo un ácido más diluido (entre el 62 % y el 78 %). El proceso de contacto produce un ácido más puro y concentrado, pero necesita materiales más limpios y catalizadores (sustancias que aceleran las reacciones) más caros. En ambos procesos, el dióxido de azufre (SO2) se transforma y se disuelve en agua.
El dióxido de azufre se obtiene quemando azufre, tostando piritas (un mineral de hierro y azufre), tostando otros minerales con azufre, o quemando gas sulfuro de hidrógeno.
Fabricación en el Laboratorio
En un laboratorio, se puede obtener ácido sulfúrico haciendo pasar gas dióxido de azufre (SO2) a través de una solución de peróxido de hidrógeno (H2O2):
Luego, esta solución se concentra evaporando el agua.
El Proceso de Cámaras de Plomo
En este proceso, el gas caliente de dióxido de azufre (SO2) entra en un reactor llamado torre de Glover. Allí se mezcla con un ácido especial y con otros gases de nitrógeno. Parte del dióxido de azufre se convierte en óxido de azufre (VI) (SO3) y se disuelve, formando un ácido sulfúrico de aproximadamente el 78 %.
Después, la mezcla de gases pasa a una cámara grande recubierta de plomo, donde se añade más agua. Aquí ocurren varias reacciones complejas que forman el ácido sulfúrico. Este ácido se acumula en el suelo de la cámara. Puede haber varias cámaras en fila. El ácido producido en estas cámaras, llamado "ácido de cámara", tiene una concentración de entre el 62 % y el 68 %.
Finalmente, los gases restantes pasan por otra torre, donde se lavan con ácido concentrado. Los óxidos de nitrógeno y el dióxido de azufre que no reaccionaron se disuelven y se reutilizan. Los gases que quedan se liberan a la atmósfera.
El Proceso de Contacto
Este proceso usa un catalizador para transformar el SO2 en SO3, y luego se le añade agua para obtener ácido sulfúrico.
Primero, una mezcla de gases secos con SO2 y oxígeno se calienta y se limpia muy bien. Luego, pasa por unos convertidores que contienen catalizadores, como el platino o el pentóxido de vanadio. Allí se forma el SO3. La conversión de SO2 a SO3 suele ser muy eficiente, alcanzando entre el 96 % y el 97 %.
Los gases que salen de los convertidores se enfrían y pasan por una torre donde se absorbe parte del SO3. Los gases que quedan pasan por una segunda torre, donde el SO3 restante se lava con ácido sulfúrico al 98 %. Los gases que no se absorben se liberan por una chimenea.
Este proceso es más eficiente si se usa azufre puro como materia prima, ya que la quema de otros minerales puede dejar impurezas que afectan el catalizador.
¿Para qué Usamos el Ácido Sulfúrico?
El azufre, en forma de sulfato, es muy importante para la nutrición de las plantas. Alrededor del 60 % de todo el ácido sulfúrico que se produce se usa para fabricar fertilizantes. La mayor parte se destina a la producción de ácido fosfórico, que a su vez se usa para hacer fertilizantes que ayudan a las plantas a absorber el fosfato. También se usa para producir nitrosulfato amónico, otro tipo de fertilizante.
Otras aplicaciones importantes incluyen:
- La refinación del petróleo.
- La producción de pigmentos (sustancias que dan color).
- El tratamiento del acero y otros metales como el cobre, el uranio y el vanadio.
- La preparación de baños especiales para purificar y recubrir metales.
- La fabricación de materiales que pueden explotar.
- La producción de detergentes, plásticos y fibras.
En la industria química, el ácido sulfúrico se usa en muchas reacciones para crear nuevos compuestos. En la industria petroquímica, ayuda a refinar y purificar los productos derivados del petróleo.
También se utiliza para producir otros ácidos importantes, como el ácido clorhídrico y el ácido fluorhídrico. Este último ha reemplazado a los clorofluorocarbonados en la industria de la refrigeración.
Algunos procesos en la industria de la madera y el papel, así como en la fabricación de textiles y el tratamiento de pieles y cuero, también requieren ácido sulfúrico.
Un uso directo muy común es en la fabricación de detergentes. Además, las baterías de los automóviles contienen soluciones diluidas de ácido sulfúrico. Es importante tener precaución, ya que incluso diluido, puede causar daños.
¡Cuidado con el Ácido Sulfúrico!
Preparar una solución de ácido sulfúrico puede ser peligroso debido al calor que se genera. Es muy importante añadir siempre el ácido concentrado al agua, y nunca al revés. Esto se debe a que el agua tiene una alta capacidad para absorber calor y el ácido tiene un punto de ebullición más alto. Si se añade agua al ácido concentrado, el ácido podría calentarse rápidamente y salpicar, lo que podría causar quemaduras.
Véase también
 En inglés: Sulfuric acid Facts for Kids
En inglés: Sulfuric acid Facts for Kids