Grafito para niños
Datos para niños Grafito |
||
|---|---|---|
 |
||
| General | ||
| Categoría | Minerales elementos nativos | |
| Clase | 1.CB.05a (Strunz) | |
| Fórmula química | C | |
| Propiedades físicas | ||
| Color | gris y gris oscuro | |
| Raya | gris oscuro | |
| Lustre | metálica | |
| Transparencia | no | |
| Sistema cristalino | Hexagonal (6/m 2/m 2/m) | |
| Hábito cristalino | Tabular, de seis caras foliada, las masas granulares compactados | |
| Exfoliación | Perfecta | |
| Fractura | Escamosa, de lo contrario en bruto, cuando no en la división | |
| Dureza | 1-2 (Mohs) | |
| Tenacidad | Escamas finas flexibles y quebradizas | |
| Densidad | 2,09 a 2,23 g/cm³ | |
| Índice de refracción | Opaco | |
| Pleocroísmo | No | |
| Solubilidad | Fundido Ni | |
| Magnetismo | diamagnético | |
El grafito es una de las formas en las que el carbono puede aparecer en la naturaleza. Otras formas conocidas son el diamante y la lonsdaleíta. A la presión y temperatura normales de nuestro ambiente, el grafito es la forma más estable de carbono. Sin embargo, un diamante tarda muchísimo tiempo en convertirse en grafito, tanto que solo se nota a lo largo de millones de años.
Fue nombrado por Abraham Gottlob Werner en 1789. La palabra "grafito" viene del griego antiguo graphein, que significa "escribir". Esto se debe a que se usa principalmente para hacer las puntas de los lápices. También se le conoce como plombagina.
Contenido
¿Dónde se encuentra el grafito?
El grafito se encuentra en rocas metamórficas, que son rocas que han cambiado por el calor y la presión. Se forma cuando los compuestos de carbono de las rocas sedimentarias se transforman. También se puede hallar en rocas ígneas y en meteoritos. Los minerales que suelen estar junto al grafito son el cuarzo, la calcita, la mica y la turmalina.
Grafito en meteoritos y el espacio
En los meteoritos, el grafito aparece junto a otros minerales. Los pequeños cristales de grafito que se encuentran en el hierro de los meteoritos se llaman cliftonita. Algunos de estos granos de grafito son tan especiales que se formaron antes de que existiera nuestro Sistema Solar. Son de los minerales más antiguos que conocemos en el Universo. Se cree que se crearon cuando estrellas muy grandes explotaron o cuando estrellas más pequeñas expulsaron sus capas exteriores al final de su vida.
Países productores de grafito
Aunque el grafito se puede fabricar, también hay muchos lugares en la Tierra donde se encuentra de forma natural. Los países que más grafito extraen son China, Mozambique, Madagascar, Corea del Sur, Rusia, Canadá, Noruega e India.
Tipos de grafito natural
Existen varios tipos principales de grafito que se encuentran en la naturaleza:
- Grafito en escamas: Se presenta como pequeñas piezas planas y delgadas, a menudo con forma hexagonal.
- Grafito amorfo: Es un tipo de grafito con escamas muy, muy finas, casi como polvo.
- Grafito en trozos: Se encuentra en grietas o vetas de las rocas. Parece una masa de cristales fibrosos.
¿Cómo es la estructura del grafito?
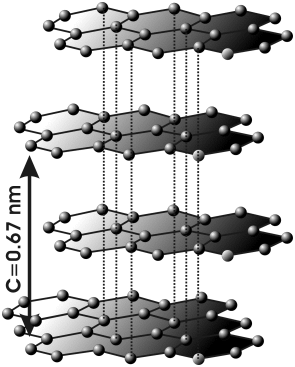
Estructura de capas
El grafito está hecho de láminas muy delgadas de carbono, llamadas grafeno. Imagina que cada lámina es como una red de panal de abejas, donde los átomos de carbono están muy unidos. La distancia entre estas láminas es muy pequeña.
La unión entre las láminas es bastante débil. Esto permite que las capas se deslicen fácilmente unas sobre otras. Por eso, el grafito es un material blando y resbaladizo.
Formas alfa y beta
El grafito tiene dos formas principales: alfa (hexagonal) y beta (romboidal). Son muy parecidas, pero se diferencian en cómo se apilan sus capas de grafeno. La forma alfa es más común y estable. La forma beta puede convertirse en alfa si se calienta a más de 1300 °C.
-
Microscopio de efecto túnel. Imagen de la superficie del grafito
-
Estructura cristalina del grafito alfa Celda unitaria
En el grafito, los átomos de carbono forman tres enlaces muy fuertes en el mismo plano, creando una estructura hexagonal. Además, tienen un orbital libre que ayuda a que el grafito conduzca la electricidad. Las uniones entre las diferentes capas son mucho más débiles. Esta estructura en láminas hace que el grafito sea un material con propiedades diferentes según la dirección.
Propiedades del grafito
El grafito es de color gris oscuro con un brillo metálico. Es un material que resiste altas temperaturas (refractario) y se rompe en láminas con mucha facilidad.
Aunque el grafito y el diamante están hechos solo de átomos de carbono, son muy diferentes. El grafito es muy blando y no deja pasar la luz, mientras que el diamante es el mineral más duro que existe y es transparente. Estas diferencias se deben a cómo están organizados los átomos de carbono en cada uno. En el grafito, los átomos forman capas hexagonales, y en el diamante, forman una red de tetraedros.
Conductividad eléctrica
El grafito conduce la electricidad. Si la electricidad viaja a lo largo de las capas, la conductividad es alta. Pero si intenta pasar de una capa a otra (perpendicularmente), la conductividad es mucho menor. Esto lo hace útil en muchas aplicaciones eléctricas.
¿Para qué se usa el grafito?
El grafito tiene muchos usos importantes:
- Es el material principal para fabricar la mina de los lápices.
- Se usa en la fabricación de ladrillos especiales y recipientes que soportan mucho calor, como los crisoles.
- Como sus capas se deslizan fácilmente, es un buen lubricante sólido.
- Se utiliza para hacer piezas en máquinas, como pistones, juntas y rodamientos.
- Gracias a que conduce la electricidad, se usa para fabricar electrodos y las escobillas de los motores.
- Se emplea en reactores nucleares para controlar la reacción.
- Algunos artistas lo usan para crear pequeñas esculturas dentro de la mina de un lápiz.
¿Cómo se fabrica el grafito artificial?
En 1893, Charles Street descubrió un método para fabricar grafito artificial. Años después, en la década de 1890, Edward Goodrich Acheson inventó otra forma de producir grafito sintético. Él estaba trabajando con carburo de silicio y notó que, al calentarlo a temperaturas muy altas (unos 4150 °C), el silicio se evaporaba y dejaba un grafito casi puro. Este grafito artificial resultó ser muy valioso como lubricante.
La técnica de Acheson para producir grafito se conoce como el proceso Acheson. En 1896, Acheson obtuvo una patente por su método, y en 1897 comenzó a producirlo a gran escala.
Compuestos de intercalación de grafito
Algunas moléculas o iones pueden entrar entre las capas del grafito. Por ejemplo, el potasio puede ceder un electrón al grafito, y el ion de potasio se queda entre las capas. Este electrón extra ayuda a que el grafito conduzca aún mejor la electricidad.
Se pueden crear diferentes tipos de estos compuestos, y en la mayoría de los casos, la conductividad del grafito aumenta.
Otras formas de carbono relacionadas
Existen otras formas de carbono que tienen una estructura parecida a la del grafito:
- Carbón vegetal y carbón activado
- Negro de humo
- Fibra de carbono
- Grafeno
- Fullereno
Véase también
 En inglés: Graphite Facts for Kids
En inglés: Graphite Facts for Kids