Sublimación para niños
La sublimación es un proceso fascinante en el que una sustancia cambia directamente de estado sólido a estado gaseoso. Esto ocurre sin pasar por el estado líquido intermedio. Imagina que un cubo de hielo se convierte en vapor sin derretirse primero.
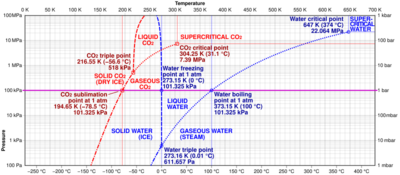
Este cambio necesita energía, por eso se le llama un proceso endotérmico (que absorbe calor). La sublimación sucede bajo ciertas condiciones de temperatura y presión. Estas condiciones son especiales y se encuentran por debajo de un punto llamado "punto triple" de la sustancia. El punto triple es la presión más baja a la que una sustancia puede existir como líquido.
El proceso contrario a la sublimación se llama deposición o sublimación inversa. En este caso, una sustancia pasa directamente de gas a sólido. A diferencia de la evaporación de un líquido, la sublimación siempre ocurre desde la superficie del sólido.
En condiciones normales de presión y temperatura, la mayoría de los compuestos y elementos tienen tres estados: sólido, líquido y gaseoso. Para que pasen de sólido a gas, normalmente necesitan pasar por el estado líquido. Sin embargo, en la sublimación, esto no ocurre. La presión importante aquí es la presión de la sustancia misma, no la presión total del ambiente. Por ejemplo, el hielo puede sublimarse en el aire justo por debajo de 0 grados Celsius. Algunas sustancias, como el carbono y el arsénico, se subliman más fácilmente que si se derritieran, porque su punto triple tiene una presión muy alta.
Es importante saber que la sublimación es un cambio físico de estado. No es una reacción química. Por ejemplo, cuando el cloruro de amonio sólido se calienta y se separa en otros gases, eso es una reacción química, no sublimación. Lo mismo ocurre con la cera de una vela al quemarse; es una reacción química con el oxígeno, no sublimación.
La sublimación ocurre porque el calor absorbido da suficiente energía a las moléculas. Así, algunas moléculas pueden vencer las fuerzas de atracción que las unen y escapar a la fase de vapor. Como este proceso requiere energía, es un cambio endotérmico. La entalpía de sublimación (o calor de sublimación) se puede calcular sumando la energía necesaria para derretir (entalpía de fusión) y la energía para evaporar (entalpía de vaporización).
Contenido
Ejemplos de Sublimación
Dióxido de Carbono

El dióxido de carbono sólido, conocido como hielo seco, es un ejemplo muy común de sublimación. A la presión atmosférica normal, el hielo seco pasa directamente de sólido a gas a una temperatura de -78.5 °C. No se derrite en un líquido. Sin embargo, si la presión es muy alta (más de 5.1 atmósferas) y la temperatura es de -56.6 °C, el dióxido de carbono sí puede existir como líquido.
Agua
La nieve y el hielo también se subliman, aunque más lentamente. Esto ocurre a temperaturas por debajo de 0 °C, siempre que la presión del vapor de agua sea baja. Un ejemplo práctico de sublimación del agua es la liofilización. En este proceso, los alimentos o materiales se congelan y luego se les reduce la presión. Esto hace que el agua congelada se sublime, eliminando la humedad y conservando el producto. La pérdida de nieve en un campo nevado durante un día frío y soleado a menudo se debe a la sublimación causada por los rayos del sol. La ablación en los glaciares es un proceso que incluye la sublimación y el desgaste del hielo.
Naftaleno
El naftaleno es un compuesto orgánico que se encuentra en productos como las bolas de naftalina. Se sublima fácilmente porque sus moléculas no son polares y se mantienen unidas por fuerzas débiles. El naftaleno es un sólido que se sublima a temperatura ambiente, alrededor de 80 °C. A bajas temperaturas, su vapor es lo suficientemente fuerte como para que el naftaleno sólido se convierta en gas. En superficies frías, los vapores de naftalina se vuelven sólidos de nuevo, formando cristales con forma de aguja.


Otras Sustancias
El yodo produce vapores cuando se calienta suavemente. Aunque esto ocurre por encima de su punto triple, lo que significa que no es una "verdadera" sublimación en el sentido estricto, es un proceso similar. Es posible obtener yodo líquido si se controla la temperatura justo por encima de su punto de fusión. En ciencia forense, el vapor de yodo se usa para encontrar huellas dactilares ocultas en papel.
El arsénico también puede sublimarse a altas temperaturas.
El cadmio y el cinc no son buenos materiales para usar en vacío porque se subliman mucho más que otros materiales comunes.
La Sublimación en el Ciclo del Agua
El agua en la Tierra existe en tres estados: sólido (hielo), líquido (agua) y gaseoso (vapor). El agua se mueve constantemente entre los océanos, los continentes y la atmósfera. Este movimiento se llama ciclo hidrológico. La energía del sol y la gravedad impulsan este ciclo.
En este ciclo, el agua de la superficie terrestre se convierte en vapor y sube a la atmósfera. Luego, regresa a la Tierra como lluvia o nieve. El agua se convierte en vapor no solo por la evaporación directa o la transpiración de plantas y animales, sino también por sublimación. Esto significa que el agua sólida (hielo o nieve) puede pasar directamente a vapor de agua.
Sublimación Inversa o Deposición
La sublimación inversa, o deposición, es el proceso opuesto a la sublimación. Es cuando un gas se convierte directamente en sólido. Por ejemplo, si calientas cristales de yodo para que se conviertan en vapor y luego pones un objeto muy frío sobre ellos, los vapores se transformarán de nuevo en cristales de yodo.
Cualquier sustancia pura puede pasar por la sublimación inversa. Esto ocurre bajo ciertas condiciones de presión y temperatura. En la naturaleza, podemos ver la sublimación inversa en la formación de la nieve o de la escarcha.
Predicciones de la Sublimación
Los científicos pueden predecir cuánta energía se necesita para la sublimación de una sustancia. Esto se hace usando cálculos basados en la energía que mantiene unidas las partículas en el sólido y la energía de las partículas en estado gaseoso.
Purificación por Sublimación
La sublimación es una técnica muy útil que los químicos usan para limpiar o purificar compuestos. Para purificar un sólido, se coloca en un aparato especial y se calienta al vacío (sin aire). Bajo esta presión reducida, el sólido se convierte en gas y luego se condensa como un compuesto puro en una superficie fría, llamada dedo frío. Las impurezas que no se volatilizan se quedan atrás. Una vez que se enfría y se quita el vacío, el compuesto purificado se puede recoger.
Para purificar aún mejor, se puede usar un cambio gradual de temperatura. Esto permite separar diferentes partes del compuesto. Esta técnica es muy importante para purificar compuestos orgánicos que se usan en la industria de la electrónica orgánica. Allí se necesitan sustancias muy, muy puras (más del 99.99%) para fabricar productos electrónicos.
Impresión por Sublimación
La impresión por sublimación es una forma de impresión digital que usa colores vibrantes. Funciona con materiales que tienen una capa de poliéster o polímero. Esta técnica se usa mucho para decorar ropa, carteles, tazas de café y otros objetos con superficies adecuadas. El proceso usa la sublimación: el calor y la presión convierten una tinta sólida en gas, sin pasar por líquido.
En la impresión por sublimación, se usan tintas especiales que se transfieren a hojas de papel "de transferencia". Luego, estas hojas se colocan en una prensa de calor junto con el objeto a imprimir.
La prensa de calor aplica una combinación de tiempo, temperatura y presión. Esta combinación hace que las tintas de sublimación se conviertan en gas y se "infundan" en el material a nivel molecular. Las tintas más comunes se activan a 176 °C, pero para obtener el mejor color, se recomienda una temperatura entre 193 y 216 °C.
El resultado final es una impresión casi permanente, con alta resolución y a todo color. Como las tintas se mezclan con el material a nivel molecular, las impresiones no se agrietan, no se desvanecen ni se desprenden fácilmente.
Las impresoras de sublimación pueden lograr una resolución muy alta, lo que significa que las imágenes son muy nítidas y detalladas. A diferencia de las impresoras de inyección de tinta, que simulan colores, las impresoras de sublimación pueden crear cualquier color en un solo punto físico. Esto evita que se vean pequeños puntos o patrones en la imagen, un problema que a veces se ve en otras impresiones.
Además, las fotos hechas por sublimación no se manchan. El paso directo de la tinta de sólido a gas y luego de gas a sólido evita este problema. Un pequeño inconveniente de esta tecnología es que es difícil obtener un negro muy claro. El negro se crea superponiendo los tres colores principales con la máxima intensidad. Por eso, no es la mejor opción para imprimir en blanco y negro. También, el costo por página puede ser alto, ya que se usa una cantidad fija de cinta de tinta para cada impresión, sin importar cuánto color tenga la página.
Véase también
 En inglés: Sublimation Facts for Kids
En inglés: Sublimation Facts for Kids
- Cambio de estado
- Estado de agregación de la materia