Carbono-14 para niños
Datos para niños Carbono-14 |
||
|---|---|---|
| Isótopo de carbono | ||
| General | ||
| Símbolo | 14C | |
| Neutrones | 8 | |
| Protones | 6 | |
| Datos del núclido | ||
| Abundancia natural | 10-10% | |
| Período de semidesintegración | 5730 ± 40 años | |
| Productos de desintegración | 14N+1 | |
| Masa atómica | 14,003 241 u | |
| Modo y energía de desintegración | ||
| β– | 0,156 476 MeV | |
| Otros | ||
Radioisótopo |
||
| Véase también: Isótopos de carbono | ||
El carbono-14, también conocido como 14C o radiocarbono, es un tipo especial de carbono. Es un isótopo radiactivo, lo que significa que su núcleo no es completamente estable. Este núcleo tiene 6 protones y 8 neutrones.
El carbono-14 se transforma con el tiempo, liberando una pequeña cantidad de energía en forma de radiación beta. Este proceso ocurre a un ritmo constante. La mitad de una cantidad de carbono-14 se desintegra en aproximadamente 5730 años. A este tiempo se le llama periodo de semidesintegración o semivida.
Como el carbono-14 se encuentra en todos los materiales orgánicos (es decir, en todo lo que estuvo vivo), los científicos lo usan en arqueología. Sirve para calcular la edad de objetos antiguos que alguna vez fueron parte de un ser vivo.
Este isótopo fue descubierto el 27 de febrero de 1940 por los científicos Martin Kamen y Sam Ruben. Más tarde, Willard Libby calculó su periodo de semidesintegración en 5568 años. Después, en la Universidad de Cambridge, se ajustó a la cifra actual de 5730 años.
Todos los seres vivos absorben carbono-14 durante su vida. Esto es clave para entender cómo funciona la datación.
Contenido
¿Cómo se forma el carbono-14?
Origen natural del carbono-14
El carbono-14 se forma de manera natural en la atmósfera de la Tierra. Esto ocurre cuando los rayos cósmicos, que son partículas de alta energía que vienen del espacio, chocan con los átomos de nitrógeno y oxígeno en la parte alta de nuestra atmósfera.
Cuando estas colisiones suceden, los átomos se rompen en partículas más pequeñas, como neutrones. Estos neutrones, al bajar a ciertas alturas, chocan con los átomos de nitrógeno. Esta colisión transforma el nitrógeno en carbono-14 y libera un protón.
También se puede formar carbono-14 por otras reacciones, pero son mucho menos comunes. Por ejemplo, los rayos en las tormentas pueden producirlo, pero en cantidades muy pequeñas.
Formación por actividades humanas
El carbono-14 también puede generarse debido a ciertas actividades humanas.
Producción por pruebas de armas
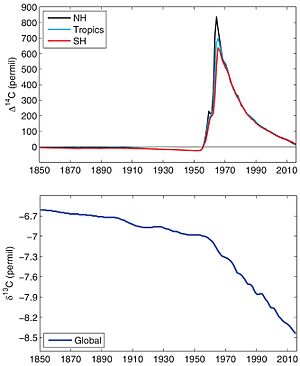
Las pruebas de ciertas armas que liberan mucha energía producen grandes cantidades de neutrones. Cuando estos neutrones chocan con el nitrógeno en la atmósfera, también crean carbono-14. Por esta razón, las pruebas realizadas en los años 1950 y 1960 aumentaron mucho la cantidad de carbono-14 en la atmósfera y en los seres vivos.
Generación en instalaciones de energía
El carbono-14 se forma en los sistemas de enfriamiento de algunas instalaciones que producen energía. Generalmente, se libera al aire como dióxido de carbono o metano. También se genera dentro de los materiales usados como combustible en estas instalaciones, especialmente por la transformación de pequeñas cantidades de nitrógeno. Si estos materiales se procesan, el carbono-14 se libera como dióxido de carbono.
En el año 2020, se estimó que la cantidad de carbono-14 producida por estas instalaciones era aproximadamente el 10% de lo que se forma de manera natural por los rayos cósmicos.
¿Cómo funciona la datación con carbono-14?
El método de datación por radiocarbono es una técnica muy útil para saber la edad de muestras orgánicas, es decir, de cosas que alguna vez estuvieron vivas y que tienen menos de 50 000 años. Se basa en cómo los isótopos radiactivos se transforman con el tiempo.
El carbono-14 se produce constantemente en la atmósfera cuando los rayos cósmicos chocan con los átomos de nitrógeno. Este carbono-14 es inestable y, con el tiempo, se convierte en nitrógeno-14. Estos procesos de creación y transformación del carbono-14 están casi en equilibrio, lo que significa que el carbono-14 se mezcla de manera uniforme con el carbono normal en el dióxido de carbono del aire.
Las plantas absorben este carbono radiactivo a través de la fotosíntesis. Así, la cantidad de carbono-14 en las plantas es similar a la que hay en el aire. Los animales, a su vez, obtienen carbono de las plantas al comerlas.
Cuando un organismo vivo muere, deja de absorber nuevo carbono-14. A partir de ese momento, la cantidad de carbono-14 en sus restos comienza a disminuir. Esto sucede porque el carbono-14 se sigue transformando en nitrógeno-14.
Sabemos que la cantidad de carbono-14 en una muestra disminuye a un ritmo constante. Por ejemplo, después de 5730 años de la muerte de un ser vivo, la cantidad de carbono-14 en sus restos se ha reducido a la mitad.
Así, al medir la cantidad de radiactividad que queda en una muestra orgánica, los científicos pueden calcular cuánto carbono-14 aún tiene. Esto les permite determinar cuándo murió el organismo. A esta edad se le llama "edad radiocarbónica" o "edad de 14C", y se expresa en "años BP" (Before Present, que significa "Antes del presente"). Esta escala cuenta los años desde la muerte del organismo hasta el año 1950. Se eligió 1950 como referencia porque, después de esa fecha, las pruebas de armas que liberan mucha energía causaron un aumento importante de carbono-14 en la atmósfera.
Al comparar los resultados de la datación con carbono-14 con la edad de maderas conocidas (determinada por el estudio de los anillos de los árboles, llamado dendrocronología), los científicos notaron algunas diferencias. Esto se debe a que la cantidad de carbono-14 en la atmósfera ha cambiado un poco a lo largo del tiempo. Hoy en día, se conoce con mucha precisión cómo ha variado la concentración de carbono-14 en los últimos 15 000 años. Esto permite corregir la edad estimada y obtener una "edad calibrada", que se expresa en "años Cal BP".
Cambios recientes en el carbono-14 atmosférico
Los combustibles fósiles, como el carbón, el petróleo y el gas natural, no contienen carbono-14. Esto es porque han estado bajo tierra por millones de años, aislados de la atmósfera. Cuando se queman, el CO2 que liberan tampoco tiene carbono-14. Por eso, el uso masivo de estos combustibles desde la Revolución Industrial ha causado una pequeña reducción en la cantidad de carbono-14 en la atmósfera.
Sin embargo, en los años 1950 y 1960, hubo un aumento repentino de carbono-14 en el aire debido a las pruebas de armas mencionadas antes. Desde entonces, la cantidad ha disminuido y, en la actualidad (2020), está cerca de los niveles que tenía antes de la Revolución Industrial. Esta disminución se debe a que el carbono-14 se ha absorbido en las plantas y animales, y se ha disuelto en los océanos. También influye el efecto continuo de la emisión de CO2 de los combustibles fósiles.
Galería de imágenes
Véase también
 En inglés: Carbon-14 Facts for Kids
En inglés: Carbon-14 Facts for Kids
- carbono
- carbono-12
- carbono-13
- datación potasio-argón