Estructura cristalina para niños
La estructura cristalina es la forma en que los átomos, moléculas o iones se organizan y empaquetan en un material sólido. Imagina que son como pequeños ladrillos que se unen de forma ordenada y repetitiva, creando patrones que se extienden en todas las direcciones.
El estudio científico de los cristales y cómo se forman se llama cristalografía. Los materiales con estructura cristalina son muy ordenados por dentro. Esto hace que tengan propiedades especiales, como ser más duros o tener formas geométricas definidas cuando se forman bien.
La parte más pequeña de este patrón repetitivo se llama celda unitaria. Piensa en ella como el "ladrillo" básico que, al repetirse una y otra vez, construye todo el cristal. La celda unitaria define la forma y la simetría de toda la red cristalina. Las medidas de esta celda (sus lados y los ángulos entre ellos) se conocen como parámetros de la red.
Contenido
¿Cómo se forman los cristales?
Dentro de un cristal, los átomos, iones o moléculas se organizan en patrones que se repiten cada una distancia muy pequeña, como 1 ángstrom (que es 0.0000000001 metros). Esta repetición en tres dimensiones se llama red cristalina.
La celda unitaria es la pieza más pequeña que, al repetirse, forma todo el cristal. Es como un molde que se usa una y otra vez para construir la estructura completa. La forma en que se organiza esta celda unitaria determina la simetría y la estructura de todo el cristal.
La estructura y la simetría de un cristal son muy importantes porque influyen en muchas de sus propiedades físicas. Por ejemplo, afectan cómo se rompe, cómo conduce la electricidad o cómo deja pasar la luz.
En los materiales inorgánicos, como la sal, los átomos o iones están muy unidos entre sí, formando una estructura fuerte y dura. En cambio, en los materiales orgánicos, como el azúcar, las unidades moleculares están unidas por fuerzas más débiles, lo que los hace más blandos y menos estables.
La celda unitaria: el bloque constructor
La estructura cristalina de un material se describe usando su celda unitaria. Esta es una pequeña "caja" que contiene uno o más átomos organizados en tres dimensiones. Al apilar estas celdas unitarias, se forma la estructura completa del cristal.
La celda unitaria se describe con sus parámetros de red: las longitudes de sus bordes (llamadas a, b y c) y los ángulos entre ellos (alfa, beta y gamma). Las posiciones de los átomos dentro de la celda se indican con coordenadas.
Índices de Miller
Los índices de Miller son una forma especial de describir las direcciones y los planos dentro de una red cristalina. Son como un sistema de coordenadas que nos ayuda a identificar dónde se encuentran los átomos o cómo se orientan ciertas superficies en el cristal.
Por ejemplo, los índices (100) se refieren a un plano específico dentro del cristal. Si un índice es cero, significa que el plano es paralelo a ese eje. Los índices negativos se indican con una barra encima del número.
Planos y direcciones importantes
Las direcciones y los planos dentro de un cristal son importantes porque afectan sus propiedades. Algunas direcciones y planos tienen más átomos o moléculas que otras. Estos planos de alta densidad influyen en:
- Propiedades ópticas: Cómo la luz interactúa con el cristal.
- Adsorción y reactividad: Cómo las sustancias se pegan a la superficie del cristal o reaccionan con él.
- Tensión superficial: La energía en la superficie del cristal.
- Defectos: Cómo se forman las imperfecciones en el cristal.
- Fractura: Cómo se rompe el cristal, a menudo a lo largo de estos planos.
- Deformación: Cómo el cristal se dobla o cambia de forma sin romperse.
Algunas direcciones y planos están definidos por la simetría del sistema cristalino. Por ejemplo, en algunos sistemas, hay un eje principal con una simetría de rotación más alta que los otros.
Estructuras cúbicas
En los cristales cúbicos, que son los más simples, los ejes son perpendiculares entre sí y tienen la misma longitud. Esto hace que los índices de Miller sean más fáciles de entender, ya que se relacionan directamente con las direcciones en un sistema de coordenadas normal.
Debido a la simetría de los cristales cúbicos, es posible cambiar el orden o el signo de los números en los índices y aun así describir direcciones o planos que son equivalentes. Por ejemplo, ⟨100⟩ representa una familia de direcciones que son iguales debido a la simetría, como [100], [010] o [001].
Clasificación de los cristales
La característica principal de un cristal es su simetría. Esto significa que si realizamos ciertas "operaciones" (como girarlo o reflejarlo), el cristal se ve exactamente igual. Todos los cristales tienen simetría de traslación (se repiten en el espacio), pero muchos también tienen otras simetrías, como la rotación o los planos de espejo.
Una clasificación completa de un cristal se logra identificando todas sus simetrías internas.
Redes de Bravais
Las redes de Bravais son una forma de agrupar las estructuras cristalinas según el sistema de ejes que se usa para describirlas. Cada sistema de red tiene un conjunto de tres ejes con una disposición geométrica particular. Hay siete sistemas de red principales:
| Familia | Red cristalina | Simetría (Sistema Schönflies) |
Redes de Bravais | |||
|---|---|---|---|---|---|---|
| Primitiva (P) | Centrada en la base (S) |
Centrada en el cuerpo (I) |
Centrada en las caras (F) |
|||
| Triclínico (a) | Ci | 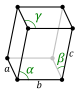
aP |
||||
| Monoclínico (m) | C2h | 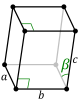
mP |
mS |
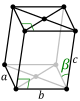
|||
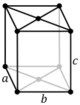
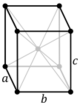
| Ortorrómbico (o) | D2h | 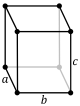
oP |
oS |
oI |

oF |
|
| Tetragonal (t) | D4h | 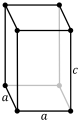
tP |
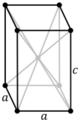
tI |
|||
| Hexagonal (h) | Romboédrico | D3d | 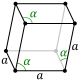
hR |
|||
| Hexagonal | D6h | 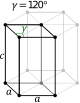
hP |
||||
| Cúbico (c) | Oh | 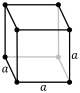
cP |
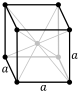
cI |

cF |
||
El sistema cúbico es el más simple y simétrico, con la forma de un cubo. Los otros seis sistemas de redes son hexagonal, tetragonal, romboédrico, ortorrómbico, monoclínico y triclínico.
Defectos e impurezas
Los cristales que encontramos en la naturaleza o que se fabrican no son perfectos. A menudo tienen pequeños "errores" o irregularidades en su organización ideal. Estos errores se llaman defectos o impurezas.
Aunque parezcan pequeños, estos defectos pueden cambiar mucho las propiedades de un material. Por ejemplo, si un átomo diferente se coloca en la estructura cristalina, puede alterar cómo el material conduce la electricidad o el calor. Las impurezas también pueden afectar las propiedades magnéticas de algunos materiales.
Polimorfismo: muchas formas para un mismo material
El polimorfismo es cuando un mismo material puede existir en varias formas cristalinas diferentes. Esto ocurre en muchos materiales, como polímeros, minerales y metales. Estas diferentes formas cristalinas dependen de condiciones como la presión y la temperatura.
Los polimorfos tienen diferentes niveles de estabilidad. Una forma puede transformarse espontáneamente en otra más estable a una temperatura específica. También pueden tener diferentes puntos de fusión, formas de disolverse y patrones cuando se les hace un análisis con rayos X.
Un ejemplo famoso es el dióxido de silicio (SiO2), que es el componente principal del cuarzo. El dióxido de silicio puede presentarse en varias formas cristalinas, y cada una tiene una estructura ligeramente diferente, aunque todas están hechas de las mismas unidades básicas.
Otro ejemplo es el estaño (Sn). A temperatura ambiente, el estaño es maleable (se puede moldear), pero si se enfría mucho, se vuelve quebradizo. Esto se debe a que el estaño tiene dos formas cristalinas principales: el estaño blanco (metálico y estable a temperatura ambiente) y el estaño gris (que tiene una estructura similar al diamante y no es metálico).
Propiedades físicas especiales
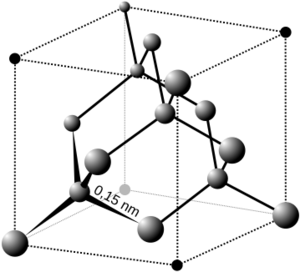
Algunos cristales tienen propiedades físicas muy interesantes. Por ejemplo, veinte de las 32 clases de cristales son piezoeléctricas. Esto significa que cuando se les aplica una presión mecánica, generan una carga eléctrica. Estos cristales no tienen un centro de simetría.
También existen los materiales piroeléctricos, que desarrollan una carga eléctrica cuando su temperatura cambia. Todos los cristales piroeléctricos son también piezoeléctricos.
Hay otras estructuras cristalinas, como la estructura de perovskita, que muestran un comportamiento ferroeléctrico. Esto es parecido al ferromagnetismo (lo que hace que un imán se pegue a la nevera), pero en lugar de magnetismo, se trata de una polarización eléctrica permanente. Un cristal ferroeléctrico puede polarizarse permanentemente al aplicar un campo eléctrico, y esta polarización puede invertirse. Es importante recordar que, aunque se llame "ferroeléctrico", el efecto se debe a la estructura del cristal, no a la presencia de hierro.
Véase también
 En inglés: Crystal structure Facts for Kids
En inglés: Crystal structure Facts for Kids
- Celda unidad
- Defectos cristalográficos en diamantes