Hidrógeno para niños
El hidrógeno (símbolo H) es el elemento químico más ligero de todos. Su número atómico es 1. Normalmente, lo encontramos como un gas llamado dihidrógeno (H2). Este gas es inflamable, no tiene color ni olor, no es metálico y no se disuelve en agua.
El hidrógeno es tan especial que no encaja fácilmente en ningún grupo de la tabla periódica. Sin embargo, a menudo se le coloca en el grupo 1 porque tiene un solo electrón en su capa más externa.
Es el elemento químico más abundante en el universo. Alrededor del 75% de la materia visible está hecha de hidrógeno. Las estrellas, como nuestro Sol, están compuestas principalmente de hidrógeno en estado de plasma. En la Tierra, el hidrógeno puro es raro. Se produce en la industria a partir de hidrocarburos, como el metano. También se usa para mejorar combustibles fósiles y para fabricar amoniaco, que se usa en fertilizantes.
El isótopo más común del hidrógeno se llama protio. Su núcleo tiene un solo protón y ningún neutrón. El hidrógeno puede formar compuestos con carga positiva (llamado hidrón, H+) o negativa (llamado hidruro, H-). También existen otros isótopos, como el deuterio (con un neutrón) y el tritio (con dos neutrones). El hidrógeno se combina con la mayoría de los elementos y es clave en el agua y en muchos compuestos orgánicos.
Datos para niños Hidrógeno → Helio |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Gas incoloro.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Hidrógeno, H, 1.0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | No metales | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 1, 1, s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 1.00784 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | 1s1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones por nivel | 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | Incoloro | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio medio | 45 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 2.2 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico (calc) | 53 pm (radio de Bohr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 37 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio de van der Waals | 120 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | -1, 1 y 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Óxido | Anfótero | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª energía de ionización | 1312 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líneas espectrales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Gas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | 0.0899 kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 14,025 K (−259 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | 20,268 K (−253 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de inflamabilidad | 255 K (−18 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de vaporización | 0.8995 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | 0.1180 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión de vapor | 209 Pa a 23 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto crítico | 23,87 K (−249 °C) 1.293 × 106 Pa |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volumen molar | 22.42 × 10-3 m3/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | hexagonal | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor específico | 1.4304 × 104 J/(kg·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad eléctrica | - S/m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 0.1815 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido | 1370 m/s a 293,15 K (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del hidrógeno | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Contenido
¿De dónde viene el nombre "Hidrógeno"?
La palabra "hidrógeno" viene del griego antiguo. Significa "que genera o produce agua". Este nombre se lo dio Antoine Lavoisier porque, al quemarse, el hidrógeno produce agua.
Historia del Hidrógeno
¿Quién descubrió el hidrógeno?
El gas hidrógeno (H2) fue producido por primera vez por T. von Hohenheim (conocido como Paracelso). Él lo obtuvo mezclando metales con ácidos fuertes. Sin embargo, no sabía que había descubierto un nuevo elemento.
En 1671, Robert Boyle volvió a describir esta reacción. Pero fue Henry Cavendish en 1766 quien reconoció el hidrógeno como una sustancia única. Lo llamó "aire inflamable" y descubrió en 1781 que al quemarse, este gas producía agua. Por eso, a Cavendish se le considera el descubridor del hidrógeno como elemento químico.
En 1783, Antoine Lavoisier le dio el nombre de "hidrógeno". Él y Laplace confirmaron el descubrimiento de Cavendish.
Usos históricos del hidrógeno

El hidrógeno se usó para llenar los primeros globos en 1783. También se utilizó en los dirigibles, que fueron una forma importante de viaje aéreo. El conde alemán Ferdinand von Zeppelin impulsó el uso del hidrógeno en dirigibles rígidos, conocidos como zepelines. El primer vuelo de un zepelín fue en 1900.
Un evento famoso relacionado con el hidrógeno fue el incidente del dirigible Hindenburg en 1937. Este dirigible, lleno de hidrógeno, se incendió en Nueva Jersey. Aunque se pensó que el hidrógeno fue la causa principal, investigaciones posteriores sugirieron que otros materiales inflamables en la cubierta del dirigible contribuyeron al fuego. A pesar de la espectacularidad del incidente, dos tercios de los pasajeros sobrevivieron.
El hidrógeno y la ciencia cuántica
El átomo de hidrógeno es muy simple, con un solo protón y un solo electrón. Por eso, ha sido clave para entender cómo funcionan los átomos y cómo se unen las moléculas. Su estudio ayudó mucho al desarrollo de la mecánica cuántica, una rama de la física que estudia el comportamiento de la materia a escalas muy pequeñas.
¿Dónde encontramos el hidrógeno en la naturaleza?

El hidrógeno es el elemento químico más abundante en el universo. Forma más del 75% de la materia normal. Es muy común en las estrellas y en los planetas gigantes gaseosos. En las estrellas, el hidrógeno se fusiona para producir energía.
En el espacio, el hidrógeno se encuentra principalmente como átomos o en estado de plasma. En este estado, los electrones y protones no están unidos. Esto le da al hidrógeno propiedades especiales, como una alta conductividad eléctrica.
En la Tierra, el gas hidrógeno (H2) es muy escaso en la atmósfera. Esto se debe a que es muy ligero y puede escapar fácilmente de la gravedad terrestre. La mayor parte del hidrógeno en la Tierra se encuentra en compuestos químicos, como el agua (H2O) y los hidrocarburos. Algunas bacterias y algas también producen gas hidrógeno.
Propiedades del Hidrógeno
¿Cómo se quema el hidrógeno?
El gas hidrógeno es muy inflamable. Se quema en el aire si su concentración es del 4% o más. Cuando se mezcla con oxígeno, puede explotar si se enciende. El hidrógeno puro se quema con una llama casi invisible, lo que hace difícil ver un fuego de hidrógeno. Por eso, se necesitan detectores especiales para detectarlo.
A diferencia de otros combustibles, cuando el hidrógeno se quema, no produce gases que contaminan el aire, como el dióxido de carbono. Solo produce vapor de agua. Por esta razón, se considera un combustible amigable con el medio ambiente.
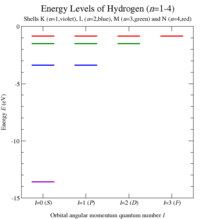
Niveles de energía de los electrones
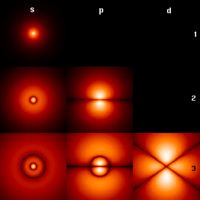
El electrón de un átomo de hidrógeno tiene niveles de energía específicos. Esto se puede explicar con el modelo atómico de Bohr, que dice que el electrón orbita alrededor del protón a ciertas distancias permitidas. La mecánica cuántica nos da una descripción aún más precisa de cómo se comporta el electrón.
Formas moleculares del hidrógeno
Existen dos tipos de moléculas de hidrógeno (H2) que se diferencian por la forma en que giran sus núcleos. Se llaman ortohidrógeno y para-hidrógeno. A temperaturas normales, el gas hidrógeno es una mezcla de ambos. A temperaturas muy bajas, casi todo el hidrógeno se convierte en para-hidrógeno. Esta conversión libera calor, lo cual es importante para almacenar hidrógeno líquido.
También existe una molécula llamada hidrógeno molecular protonado, H3+. Se encuentra en el espacio entre las estrellas y es uno de los iones más comunes en el universo.
Hidrógeno metálico
Aunque el hidrógeno es un no metal, a temperaturas y presiones muy altas puede comportarse como un metal. En 1996, científicos lograron producir hidrógeno metálico por un instante en el laboratorio.
Compuestos de Hidrógeno
El hidrógeno forma muchos compuestos químicos con casi todos los elementos.
- Compuestos covalentes y orgánicos: El hidrógeno se une al carbono para formar millones de hidrocarburos, que son la base de la química orgánica y la Bioquímica. También se une a elementos como el flúor, oxígeno o nitrógeno formando enlaces especiales llamados "enlace de hidrógeno" o "puente de hidrógeno", que son muy importantes en las moléculas biológicas. Ejemplos son el agua (H2O) y el amoniaco (NH3).
- Hidruros: Son compuestos donde el hidrógeno se une a metales o semimetales. En estos casos, el hidrógeno puede tener una carga parcial negativa.
Isótopos del Hidrógeno
El hidrógeno tiene tres isótopos principales que se encuentran en la naturaleza:
- Protio (1H): Es el más común, con más del 99.98% del hidrógeno. Su núcleo tiene solo un protón y ningún neutrón.
- Deuterio (2H o D): Su núcleo tiene un protón y un neutrón. Es estable y no es radiactivo. El agua que contiene deuterio se llama agua pesada. Se usa en reactores nucleares y en investigaciones científicas.
- Tritio (3H o T): Su núcleo tiene un protón y dos neutrones. Es radiactivo y se descompone en helio en unos 12.33 años. Se encuentra en pequeñas cantidades en la naturaleza y se usa en investigación y en algunos dispositivos luminosos.
El hidrógeno es el único elemento que tiene nombres diferentes para cada uno de sus isótopos naturales.
¿Cómo se produce el hidrógeno?
Producción industrial
La mayor parte del hidrógeno que se usa en la industria se obtiene del gas natural o de otros hidrocarburos líquidos. Esto se hace a altas temperaturas, haciendo reaccionar vapor de agua con metano. Esta reacción produce monóxido de carbono y H2.
También se puede producir hidrógeno a partir del agua mediante un proceso llamado electrólisis. En este proceso, una corriente eléctrica pasa a través del agua, separándola en gas hidrógeno y gas oxígeno. Este método es más caro que el que usa gas natural.
Producción en laboratorio
En los laboratorios, el gas hidrógeno se suele preparar haciendo reaccionar ácidos con metales como el zinc. También se puede usar la electrólisis del agua, que es un método sencillo.
Usos del Hidrógeno
En la industria
El hidrógeno se usa en grandes cantidades en la industria del petróleo y la química. Por ejemplo, se utiliza para mejorar los combustibles y para producir amoniaco. También se usa como agente reductor para obtener metales de sus minerales.
En física e ingeniería, el hidrógeno se usa como gas de protección en la soldadura. También se emplea para enfriar generadores en centrales eléctricas porque es el gas que mejor conduce el calor. El hidrógeno líquido se usa en investigaciones a temperaturas muy bajas (criogenia).
El hidrógeno puro o mezclado con nitrógeno se usa para detectar fugas en muchas industrias, como la automotriz o la aeroespacial.
Como portador de energía
El hidrógeno no es una fuente de energía en sí mismo, sino un "portador" de energía, como una batería. Esto significa que se necesita energía para producirlo, y luego esa energía se libera cuando se quema. La energía del Sol viene de la fusión de hidrógeno, pero lograr esto de forma controlada en la Tierra es muy difícil.
El hidrógeno se ha considerado como un posible combustible futuro para el transporte. Cuando se quema, no produce dióxido de carbono, lo que lo hace más amigable con el medio ambiente.
En la industria de semiconductores
El hidrógeno se usa para mejorar las propiedades de materiales como el silicio amorfo y el carbono amorfo, que son importantes en la fabricación de semiconductores.
Seguridad al usar Hidrógeno
El hidrógeno puede ser peligroso. Es muy inflamable y puede causar incendios o explosiones si se mezcla con el aire. En su forma pura, sin oxígeno, puede ser un asfixiante. El hidrógeno líquido es extremadamente frío y puede causar quemaduras por congelación.
Además, el hidrógeno puede disolverse en algunos metales, haciéndolos más frágiles. Los fuegos de hidrógeno son difíciles de ver porque sus llamas son casi invisibles, lo que aumenta el riesgo de quemaduras accidentales.
Galería de imágenes
Véase también
 En inglés: Hydrogen Facts for Kids
En inglés: Hydrogen Facts for Kids