Amoníaco para niños
Datos para niños
Amoníaco |
||
|---|---|---|
 Estructura química
|
||
 Estructura tridimensional
|
||
| Nombre IUPAC | ||
| Azano | ||
| General | ||
| Otros nombres | Hidruro de nitrógeno Trihidruro de nitrógeno Espíritus de Hartshorn |
|
| Fórmula estructural | 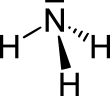 |
|
| Fórmula molecular | NH3 | |
| Identificadores | ||
| Número CAS | 7664-41-7 | |
| Número RTECS | BO0875000 (anhidro) BQ9625000 (soluciones) |
|
| ChEBI | 16134 | |
| ChEMBL | CHEMBL1160819 | |
| ChemSpider | 217 | |
| DrugBank | DB11118 | |
| PubChem | 134988186 | |
| UNII | 5138Q19F1X | |
| KEGG | C00014 D02916, C00014 | |
|
InChI
InChI=InChI=1S/H3N/h1H3
Key: QGZKDVFQNNGYKY-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | Incoloro Olor penetrante y desagradable |
|
| Densidad | 0,723 kg/m³; 0,000723 g/cm³ | |
| Masa molar | 17,021 g/mol | |
| Punto de fusión | 195,42 K (−78 °C) | |
| Punto de ebullición | 239,81 K (−33 °C) | |
| Punto de descomposición | 773 K (500 °C) <head> | |
| Temperatura crítica | 405,5 K (132 °C) | |
| Presión crítica | 111.52 atm | |
| Índice de refracción (nD) | 1.355 | |
| Propiedades químicas | ||
| Acidez | 9.24 pKa | |
| Alcalinidad | 5 pKb | |
| Solubilidad en agua | 89.9 g/100 ml (0 °C) | |
| Momento dipolar | 1.42 D | |
| Familia | 15 | |
| Termoquímica | ||
| ΔfH0gas | -45.92 kJ/mol | |
| ΔfH0líquido | -40.2 kJ/mol | |
| S0gas, 1 bar | 192.77 J·mol–1·K | |
| Capacidad calorífica (C) | 4700 kJ/kg·K (liq) 80.08 J/mol·K |
|
| Peligrosidad | ||
| SGA |     |
|
| Punto de inflamabilidad | 284 K (11 °C) | |
| NFPA 704 |
1
3
0
|
|
| Temperatura de autoignición | 924 K (651 °C) | |
| Frases R | R10, R23, R34, R50 | |
| Frases S | (S1/2), S9, S16, S26, S36/37/39, S45, S61 | |
| Frases H | H221, H314, H331, H400 | |
| Límites de explosividad | 15–28 % | |
| Riesgos | ||
| Ingestión | Es peligroso. Síntomas incluyen náusea y vómitos, daño a los labios, boca y esófago. | |
| Inhalación | Los vapores son extremadamente irritantes y corrosivos. | |
| Piel | Disoluciones concentradas pueden producir quemaduras severas y necrosis. | |
| Ojos | Puede causar daños permanentes, incluso en cantidades pequeñas. | |
| Más información | Hazardous Chemical Database | |
| Compuestos relacionados | ||
| Hidruros relacionados | Arsina Fosfina Estibina Bismutina |
|
| Hidruros de nitrógeno relacionados | Hidrazina Ácido azothídrico |
|
| Otros compuestos | Hidróxido de amonio | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El amoníaco (también conocido como azano o trihidruro de nitrógeno) es un compuesto químico formado por nitrógeno e hidrógeno, con la fórmula NH3. Es un gas sin color, pero con un olor muy fuerte y fácil de reconocer. El amoníaco es muy importante para la vida en la Tierra, ya que se usa para crear fertilizantes que ayudan a las plantas a crecer. También se utiliza en la fabricación de muchos productos que usamos a diario, como cosméticos, tintes para el cabello y productos de limpieza.
Aunque es muy útil, el amoníaco debe manejarse con cuidado. En 2012, se produjeron 198 millones de toneladas de amoníaco a nivel industrial. Esto muestra lo mucho que se usa en el mundo.
El amoníaco se convierte en líquido a -33.34 °C bajo presión normal. Esto permite guardarlo en estado líquido a bajas temperaturas. El amoníaco que usamos en casa, llamado hidróxido de amonio, es una mezcla de amoníaco y agua.
Contenido
- Amoníaco: Un Compuesto Químico Importante
- Detección del Amoníaco
- Historia del Amoníaco
- Usos del Amoníaco
- Precauciones de seguridad con el Amoníaco
- Producción industrial del Amoníaco
- Manejo del producto
- Amoníaco como solvente líquido
- El papel del amoníaco en sistemas biológicos
- Amoníaco en el espacio
- Véase también
Amoníaco: Un Compuesto Químico Importante
¿Qué es el Amoníaco?
El amoníaco es un gas sin color con un olor muy fuerte y particular. Se forma de manera natural cuando la materia orgánica (como plantas y animales muertos) se descompone. También se produce en grandes cantidades en fábricas. Es un gas que se disuelve fácilmente en agua y se evapora rápido. Generalmente, se vende en forma líquida.
La cantidad de amoníaco que se produce en la industria cada año es casi la misma que la que se forma en la naturaleza. Las bacterias en el suelo, las plantas y los animales en descomposición, y los desechos de animales, todos producen amoníaco. Es esencial para muchos procesos biológicos.
¿Para qué se usa el Amoníaco?
La mayor parte del amoníaco que se produce (más del 80%) se usa para fabricar abonos o se aplica directamente como fertilizante en los campos. El resto se utiliza en la fabricación de textiles, plásticos, explosivos, papel, alimentos, bebidas, productos de limpieza para el hogar y como refrigerante. También se encuentra en las sales aromáticas.
Como el amoníaco es una base (lo contrario de un ácido), puede reaccionar con ácidos para formar sales de amonio.
El nombre "amoníaco" fue dado por el químico sueco Torbern Bergman. Lo llamó así por el gas que se obtenía de los depósitos de sal cerca del templo de Amón en la antigua Libia.
¿Dónde se encuentra el Amoníaco en la naturaleza?
El amoníaco se encuentra en pequeñas cantidades en el aire, producido por la descomposición de plantas y animales. También hay amoníaco y sales de amonio en el agua de lluvia. En zonas volcánicas, se encuentran sales como el cloruro de amonio y el sulfato de amonio. Incluso en la Patagonia, se han hallado cristales de bicarbonato de amonio en el guano (excremento de aves). Nuestros riñones también producen amoníaco para mantener el equilibrio del cuerpo.
Además, el amoníaco está presente en otras partes del sistema solar, como en las atmósferas de Marte, Júpiter, Saturno, Urano, Neptuno y Plutón. Las sustancias que contienen amoníaco o son similares a él se llaman amoniacales.
¿Cómo se comporta el Amoníaco?
El amoníaco es un gas sin color con un olor muy fuerte. Es más ligero que el aire. Se vuelve líquido fácilmente porque sus moléculas se atraen mucho entre sí. El amoníaco líquido hierve a –33.3 °C y se congela a –77.7 °C, formando cristales blancos.
El amoníaco se puede quitar el olor fácilmente si reacciona con un ácido. Así se forman sales de amonio que no huelen.
Amoníaco en estado sólido
Cuando el amoníaco está en estado sólido, sus cristales tienen una forma cúbica.
Amoníaco en estado líquido
El amoníaco líquido tiene la capacidad de separar iones, lo que significa que puede disolver muchas sustancias. También necesita mucha energía para pasar de líquido a gas, por eso se usa en sistemas de refrigeración.
Solubilidad en agua
El amoníaco se mezcla muy bien con el agua. Una vez mezclado, se puede separar hirviendo la solución. La mezcla de amoníaco en agua es una base. El amoníaco que usamos en casa para limpiar es una solución de amoníaco en agua.
¿El amoníaco se quema?
El amoníaco por sí solo no se quema ni mantiene una llama, a menos que esté mezclado con un 15% a 25% de aire. Cuando se mezcla con oxígeno, se quema con una llama de color verde amarillento. A altas temperaturas y con la ayuda de un catalizador, el amoníaco se separa en sus elementos.
Estructura del Amoníaco
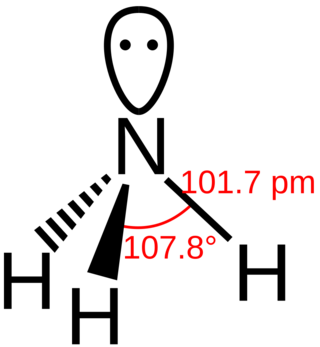
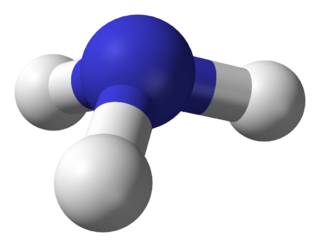
La molécula de amoníaco tiene una forma de pirámide triangular. El átomo de nitrógeno en el centro tiene un par de electrones que no están unidos a ningún otro átomo. Esto hace que el amoníaco sea una base, lo que significa que puede aceptar protones. Esta forma también le da a la molécula una "polaridad", lo que la hace muy soluble en agua. Una solución de amoníaco en agua es ligeramente básica.
La molécula de amoníaco puede cambiar de forma rápidamente a temperatura ambiente, como un paraguas que se voltea con el viento.
¿Cómo reacciona el Amoníaco?
Una de las características más importantes del amoníaco es que es una base débil. Se une con los ácidos para formar sales. Por ejemplo, con el ácido clorhídrico forma cloruro de amonio. Para que esta reacción ocurra, se necesita agua. Si abres botellas de amoníaco concentrado y ácido clorhídrico cerca, verás una "nube" de cloruro de amonio formarse en el aire.
- NH3 + HCl → NH4Cl
Las sales que se forman cuando el amoníaco reacciona con ácidos se llaman compuestos de amonio, que contienen el ion amonio (NH4+).
Aunque el amoníaco es una base débil, también puede actuar como un ácido muy débil. Puede formar otras sustancias llamadas aminas.
Auto-disociación
Al igual que el agua, el amoníaco puede separarse en iones más pequeños, formando sus propias bases y ácidos.
Combustión del Amoníaco
Cuando el amoníaco se quema, produce nitrógeno molecular y agua. Esta reacción libera calor.
- 4 NH3 + 3 O2 → 2 N2 + 6 H2O (g)
El nitrógeno molecular es el producto más estable de la combustión del amoníaco. Sin embargo, en presencia de un catalizador adecuado, se pueden formar otros compuestos de nitrógeno, lo cual es muy importante en la industria para producir ácido nítrico.
- 4 NH3 + 5 O2 → 4 NO + 6 H2O
La combustión del amoníaco en el aire es difícil sin un catalizador. El amoníaco solo se enciende en el aire si está en una mezcla con un 16% a 25% de amoníaco.
Formación de otros compuestos
En la química orgánica, el amoníaco puede unirse a otras moléculas para formar aminas. Por ejemplo, la metilamina se produce al reaccionar amoníaco con clorometano.
También se pueden formar amidas al reaccionar amoníaco con ciertos derivados de ácidos.
El hidrógeno en el amoníaco puede ser reemplazado por metales. Por ejemplo, el magnesio se quema en gas amoníaco para formar nitruro de magnesio.
Amoníaco como ligando
El amoníaco puede unirse a metales de transición para formar complejos. Por ejemplo, el amoníaco forma un complejo con la plata que se usa en el reactivo de Tollen.
Detección del Amoníaco
Amoníaco en solución
El amoníaco y las sales de amonio se pueden detectar fácilmente, incluso en cantidades muy pequeñas, usando la solución de Nessler, que cambia a un color amarillo.
Amoníaco gaseoso
Para detectar pequeñas fugas de amoníaco en sistemas de refrigeración, se pueden usar varillas de azufre que se queman. Cantidades más grandes se detectan calentando las sales con una sustancia alcalina, lo que libera el olor característico del amoníaco.
El amoníaco es un irritante, y la irritación aumenta con la concentración. El límite de exposición permitido es de 25 partes por millón (ppm). Concentraciones más altas son difíciles de detectar con los métodos comunes.
Nitrógeno amoniacal (NH3-N)
El nitrógeno amoniacal es una medida que se usa para saber la cantidad de iones amonio en el agua o en líquidos de desecho. Esto es importante para controlar la calidad del agua y los sistemas de purificación. Se mide en miligramos por litro (mg/L).
Historia del Amoníaco

Los romanos llamaron "sal ammoniacus" a los depósitos de cloruro de amonio que se encontraban cerca del templo de Amón en Libia. Las sales de amoníaco se conocen desde hace mucho tiempo.
En la Edad Media, el amoníaco se usaba para teñir telas. En el siglo XV, Basilius Valentinus demostró cómo obtener amoníaco.
El amoníaco gaseoso fue aislado por primera vez por Joseph Priestley en 1774, quien lo llamó "aire alcalino". Once años después, en 1785, Claude Louis Berthollet descubrió de qué estaba compuesto.
La forma de producir amoníaco a partir del nitrógeno del aire y el hidrógeno fue inventada por Fritz Haber y Robert LeRossignol. Luego, Carl Bosch desarrolló el proceso para producirlo a gran escala (conocido como el Proceso de Haber-Bosch). Este proceso se usó por primera vez a nivel industrial en Alemania durante la Primera Guerra Mundial. Fritz Haber recibió el Premio Nobel de Química en 1918 por este descubrimiento. Este proceso ha sido clave para la producción de fertilizantes, ayudando a alimentar a millones de personas en el mundo.
Usos del Amoníaco
Fertilizante
Alrededor del 83% del amoníaco producido se usa como fertilizante. Ayuda a aumentar la producción de cultivos como el maíz y el trigo.
Base para otros compuestos de nitrógeno
El amoníaco es el punto de partida para fabricar la mayoría de los compuestos que contienen nitrógeno. Uno de los más importantes es el ácido nítrico, que se usa para producir más fertilizantes y otros productos.
Limpiador
El amoníaco casero es una solución de amoníaco en agua que se usa para limpiar superficies, como cristales, porcelana y acero inoxidable. También es útil para limpiar hornos. El amoníaco casero suele tener entre un 5% y un 10% de amoníaco.
Fermentación
Las soluciones de amoníaco se usan en la industria de la fermentación para dar nitrógeno a los microorganismos y controlar el nivel de acidez (pH) durante el proceso.
Agente para la seguridad alimentaria
El amoníaco se ha usado para reducir la presencia de bacterias en algunos alimentos para animales. Por ejemplo, se ha utilizado para tratar recortes de carne y reducir la presencia de ciertas bacterias.
Refrigeración - R717
El amoníaco es un buen refrigerante debido a sus propiedades de vaporización. Se usaba mucho antes de que se popularizaran otros compuestos. El amoníaco puro se sigue usando en la industria de la refrigeración y en pistas de hockey por su eficiencia y bajo costo. Sin embargo, no se usa mucho en casa porque puede ser perjudicial.
Para limpiar gases de escape
El amoníaco se usa para eliminar el dióxido de azufre (SO2) de los gases calientes de combustión. También ayuda a neutralizar los óxidos de nitrógeno (NOx) que emiten los motores diésel.
Como combustible
El amoníaco se ha usado como combustible en camiones y en algunos motores de cohetes, como el de la nave X-15. Aunque no es un combustible tan potente como otros, tiene ventajas en el diseño de vehículos.
Se ha propuesto el amoníaco como una alternativa a los combustibles fósiles para motores de combustión interna. Su valor energético es menor que el del diésel. Un coche podría usar amoníaco líquido si el tanque está bajo la presión adecuada.
La producción de amoníaco a gran escala para combustible requeriría mucha inversión. Aunque es el segundo compuesto químico más producido, la cantidad de amoníaco es mucho menor que la del petróleo que se usa en el mundo. Se puede producir usando energías renovables.
En 1981, una compañía canadiense modificó un coche para que funcionara con amoníaco.
Como estimulante
El amoníaco, en forma de vapor de sales aromáticas, se usa a veces como estimulante para la respiración.
En la Industria Textil
El amoníaco líquido se usa para tratar materiales de algodón y para prelavar la lana.
Gas de levantamiento
El amoníaco es menos denso que el aire, por lo que puede usarse para llenar globos meteorológicos. Tiene aproximadamente el 60% de la capacidad de levantamiento del hidrógeno o el helio.
Tratamiento de la madera
El amoníaco también se usa para oscurecer la madera de roble blanco en muebles. Los vapores de amoníaco reaccionan con las sustancias naturales de la madera, cambiando su color.
Cosmética
El amoníaco es un ingrediente en los tintes para el cabello. Es el responsable del olor característico de estos productos.
Precauciones de seguridad con el Amoníaco
Las autoridades de seguridad han establecido límites para la exposición al amoníaco en el aire. Por ejemplo, se recomienda no exponerse a más de 35 partes por millón (ppm) durante 15 minutos, o 25 ppm durante 8 horas. El amoníaco tiene un olor muy fuerte que sirve como advertencia. El olor se puede detectar a partir de 5 ppm, un nivel que no es perjudicial. Sin embargo, la exposición a concentraciones muy altas de gas amoníaco puede causar problemas respiratorios.
Efectos en el cuerpo
Las soluciones de amoníaco no suelen causar problemas graves a los humanos o a otros mamíferos, ya que el cuerpo tiene formas de procesarlo. Sin embargo, para los peces y anfibios, el amoníaco, incluso en pequeñas cantidades, puede ser muy perjudicial.
En la acuicultura
Se cree que el amoníaco puede ser una causa de la pérdida de peces en criaderos. Si hay demasiado amoníaco, puede afectar el metabolismo de los peces y aumentar el nivel de acidez en su cuerpo. La tolerancia al amoníaco varía entre las especies de peces. Incluso concentraciones bajas (alrededor de 0.05 mg/L) pueden afectar el crecimiento, la fertilidad y hacer que los peces sean más propensos a enfermedades. En concentraciones más altas (más de 2.00 mg/L), el amoníaco puede causar problemas en los tejidos, letargo y otros problemas graves.
Durante el invierno, cuando los peces comen menos, los niveles de amoníaco pueden aumentar. Es importante prevenir estos niveles altos para proteger a los peces.
Almacenamiento del Amoníaco
El amoníaco puro se evapora a temperaturas bajas bajo presión normal. Por eso, los recipientes para guardarlo deben soportar cierta presión. El amoníaco no debe mezclarse con bases (sustancias alcalinas) a menos que se busque una reacción específica, ya que podría liberar cantidades significativas de amoníaco.
Uso en casa
Las soluciones de amoníaco (5-10%) se usan en limpiadores caseros. Estas soluciones pueden irritar los ojos y las mucosas. Es muy importante nunca mezclar estas soluciones con productos que contengan cloro o blanqueadores, ya que pueden producir gases perjudiciales.
Uso en el laboratorio
Los riesgos de las soluciones de amoníaco dependen de su concentración. Las soluciones "diluidas" suelen tener entre 5% y 10% de amoníaco, mientras que las concentradas pueden tener alrededor del 25%.
| Concentración por masa (m/m) |
Molaridad | Concentración masa/volumen (m/v) |
Clasificación |
|---|---|---|---|
| 5–10% | 2.87–5.62 mol/L | 48.9–95.7 g/L | Irritante (Xi) |
| 10–25% | 5.62–13.29 mol/L | 95.7–226.3 g/L | Corrosivo (C) |
| >25% | >13.29 mol/L | >226.3 g/L | Corrosivo (C) Perjudicial para el ambiente (N) |
El vapor de amoníaco de soluciones concentradas puede irritar gravemente los ojos y las vías respiratorias. Estas soluciones deben manejarse con cuidado, preferiblemente en un lugar con buena ventilación. Las soluciones de amoníaco no deben mezclarse con halógenos, ya que pueden formar productos perjudiciales.
El amoníaco puro (gas o líquido) puede formar mezclas inflamables con el aire. El amoníaco puro puede corroer aleaciones de cobre y zinc, por lo que no deben usarse para almacenarlo. También puede afectar el caucho y algunos plásticos.
Producción industrial del Amoníaco
¿Cómo se fabrica el Amoníaco?
El amoníaco se produce principalmente mediante el proceso Haber-Bosch, llamado así por Fritz Haber y Carl Bosch. Este proceso consiste en combinar directamente nitrógeno y hidrógeno gaseosos.
N2(g) + 3H2(g) → 2NH3(g)
Esta reacción es lenta, por lo que se usa un catalizador (generalmente óxido de hierro) para acelerarla. También se realiza a altas temperaturas y presiones para que se forme más amoníaco. A medida que el amoníaco se produce, se retira para que la reacción siga avanzando.
El hidrógeno necesario para este proceso se obtiene del gas natural o de otros combustibles.
Manejo del producto
- El amoníaco puede encenderse en el aire en concentraciones de 19% a 25% en volumen.
- Se autoenciende a 651 °C.
- Para apagar un fuego de amoníaco, se puede usar agua, dióxido de carbono o productos químicos secos.
- Es importante usar protección respiratoria, como máscaras, y guantes al manipularlo.
- No se debe ingerir.
Amoníaco como solvente líquido
El amoníaco líquido se estudia como un solvente que no es agua. Puede disolver metales como el litio, el sodio y el potasio, formando soluciones de colores intensos que conducen la electricidad.
El amoníaco líquido tiene un punto de ebullición, de fusión, densidad y viscosidad más bajos que el agua. Esto se debe a que los enlaces entre sus moléculas son más débiles que los del agua.
Solubilidad de sales
| Solubilidad (gramos de sal por 100 gramos de NH3 líquido ) | |
|---|---|
| Acetato de amonio | 253.2 |
| Nitrato de amonio | 389.6 |
| Nitrato de litio | 243.7 |
| Nitrato de sodio | 97.6 |
| Nitrato de potasio | 10.4 |
| Fluoruro de sodio | 0.35 |
| Cloruro de sodio | 157.0 |
| Bromuro de sodio | 138.0 |
| Yoduro de sodio | 161.9 |
| Tiocianato de sodio | 205.5 |
El amoníaco líquido puede disolver muchas sales, como nitratos y cianuros. La mayoría de las sales de amonio son solubles en amoníaco líquido.
Soluciones de metales
El amoníaco líquido disuelve metales como el litio, el calcio y el magnesio. A bajas concentraciones, estas soluciones son de color azul oscuro y contienen electrones libres. Estas soluciones son muy útiles para ciertas reacciones químicas.
El papel del amoníaco en sistemas biológicos
El amoníaco es una fuente importante de nitrógeno para los seres vivos. Aunque el nitrógeno es abundante en el aire, pocos organismos pueden usarlo directamente. Por eso, la "fijación de nitrógeno" es necesaria para crear aminoácidos, que son los bloques de construcción de las proteínas.
¿Cómo se produce en los seres vivos?
En algunos organismos, el amoníaco se produce a partir del nitrógeno del aire gracias a una enzima llamada nitrogenasa. Este proceso se llama fijación de nitrógeno.
El amoníaco también se produce en el cuerpo como resultado del metabolismo de los aminoácidos. Los animales marinos suelen eliminar el amoníaco directamente. En los humanos, el amoníaco se convierte en urea en el hígado, que es menos perjudicial y se elimina por la orina.
En la fisiología
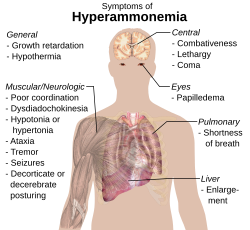
El amoníaco también es importante para el equilibrio ácido/base del cuerpo. El hígado convierte el amoníaco en urea a través de un proceso llamado ciclo de la urea. Si el hígado no funciona bien, puede haber una cantidad elevada de amoníaco en la sangre.
El amoníaco se elimina por la orina, ayudando a nuestro cuerpo a deshacerse de los ácidos.
Eliminación del amoníaco del cuerpo
Los iones de amoníaco son productos de desecho del metabolismo de los animales. Los peces y los invertebrados acuáticos los eliminan directamente en el agua. Los mamíferos, tiburones y anfibios los convierten en urea para que sean menos perjudiciales. Las aves, reptiles y caracoles terrestres convierten el amoníaco en ácido úrico, que es sólido y se elimina con poca pérdida de agua.
Amoníaco en el espacio

Se ha encontrado amoníaco en la atmósfera de los planetas gigantes gaseosos, como Júpiter y Saturno. También se encuentra en las lunas de Marte, Deimos y Fobos.
Espacio interestelar
El amoníaco fue detectado por primera vez en el espacio en 1968. Fue la primera molécula compleja que se encontró. Debido a que es fácil de observar, el amoníaco se ha convertido en una molécula muy importante para estudiar las nubes moleculares en el espacio. La intensidad de las señales de amoníaco puede usarse para medir la temperatura de estas nubes.
Se han detectado diferentes tipos de amoníaco en el espacio, incluyendo aquellos con deuterio. Se cree que las bajas temperaturas en el espacio permiten que estas moléculas se formen y se acumulen.
El estudio del amoníaco en el espacio ha sido muy importante para la investigación en astronomía.
¿Cómo se forma y se destruye el amoníaco en el espacio?
La principal forma en que se forma el amoníaco en el espacio es a través de una reacción entre el ion amonio (NH4+) y los electrones.
- NH4+ + e− → NH3 + H·
Hay muchas reacciones que pueden destruir el amoníaco en el espacio, pero las más importantes son las que lo hacen reaccionar con otros iones.
Detección con telescopios
Los radiotelescopios han detectado amoníaco en diferentes regiones de nuestra galaxia, incluyendo zonas donde se forman estrellas. Esto indica que el amoníaco es una molécula común en el espacio y que las regiones de alta densidad son frecuentes en la galaxia.
También se ha detectado amoníaco en otras galaxias, lo que permite a los científicos medir la temperatura del gas en ellas.
Detecciones infrarrojas
Se han registrado absorciones de amoníaco sólido en granos de polvo interestelar. Esto ha ayudado a entender la composición del hielo en el espacio.
También se ha estudiado el amoníaco en la atmósfera de Júpiter usando telescopios especiales.
Las observaciones de amoníaco en nubes oscuras (regiones frías y densas en el espacio) muestran que estas nubes tienen temperaturas bajas y poca turbulencia. Esto sugiere que son lugares donde podrían formarse estrellas en el futuro.
Regiones HII ultracompactas
Las regiones HII ultracompactas son lugares donde se forman estrellas muy grandes. El amoníaco es una herramienta valiosa para estudiar el material molecular denso que rodea estas regiones.
Detección extragaláctica
El amoníaco se ha detectado en galaxias fuera de la nuestra. Al medir varias señales de amoníaco, es posible determinar la temperatura del gas en estas galaxias. Esto ayuda a los científicos a entender cómo se forman las estrellas en otras galaxias.
Véase también
 En inglés: Ammonia Facts for Kids
En inglés: Ammonia Facts for Kids