Etanol para niños
Datos para niños
Etanol |
||
|---|---|---|
 Fórmula estructural de la molécula de etanol.
|
||
 Estructura tridimensional.
|
||
| Nombre IUPAC | ||
| Etanol | ||
| General | ||
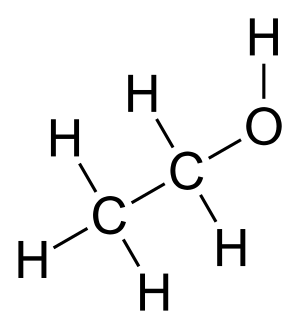
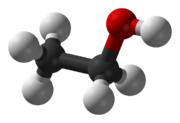
| Fórmula semidesarrollada | <chem>CH3-CH2-OH</chem> | |
| Fórmula estructural | <chem>C2H5OH</chem> | |
| Fórmula molecular | <chem>C2H6O</chem> | |
| Identificadores | ||
| Número CAS | 64-17-5 | |
| Número RTECS | KQ6300000 | |
| ChEBI | 16236 | |
| ChEMBL | CHEMBL545 | |
| ChemSpider | 682 | |
| DrugBank | DB00898 | |
| PubChem | 702 | |
| UNII | 3K9958V90M | |
| KEGG | D00068, C00469 D06542, D00068, C00469 | |
|
InChI
InChI=InChI=1S/C2H6O/c1-2-3/h3H,2H2,1H3
Key: LFQSCWFLJHTTHZ-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | Incoloro | |
| Densidad | 789 kg/m³; 0,789 g/cm³ | |
| Masa molar | 46,08 g/mol | |
| Punto de fusión | 158,9 K (−114 °C) | |
| Punto de ebullición | 351,6 K (78 °C) | |
| Temperatura crítica | 514 K (241 °C) | |
| Presión crítica | 63 atm | |
| Estructura cristalina | sistema cristalino monoclínico | |
| Viscosidad | 1,074 mPa·s a 20 °C. | |
| Índice de refracción (nD) | 1,3611 | |
| Propiedades químicas | ||
| Acidez | 15.9 pKa | |
| Solubilidad en agua | Miscible | |
| Termoquímica | ||
| ΔfH0gas | -235.3 kJ/mol | |
| ΔfH0líquido | -277.6 kJ/mol | |
| S0líquido, 1 bar | 161.21 J·mol–1·K–1 | |
| Peligrosidad | ||
| SGA |   |
|
| Punto de inflamabilidad | 286 K (13 °C) | |
| NFPA 704 |
3
1
0
|
|
| Temperatura de autoignición | 636 K (363 °C) | |
| Frases R | R11 R61 | |
| Frases S | S2 S7 S16 | |
| Límites de explosividad | 3.3 a 19 % | |
| Compuestos relacionados | ||
| alcoholes | Metanol, Propanol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El etanol, también conocido como alcohol etílico, es un compuesto químico orgánico. Es un tipo de alcohol que se presenta como un líquido incoloro en condiciones normales. Tiene un olor fuerte y es muy fácil de encender. Su punto de ebullición es de 78.4 °C.
El etanol se puede mezclar con agua en cualquier cantidad. Se ha obtenido desde hace mucho tiempo mediante la fermentación de azúcares. Es el componente principal en algunas bebidas como el vino o la cerveza.
Contenido
¿Qué significa la palabra Etanol?
El nombre etanol es el que le dio la Unión Internacional de Química Pura y Aplicada (IUPAC). Este nombre nos dice que la molécula tiene dos átomos de carbono (por el prefijo "et-"). También indica que hay un solo enlace entre ellos (por el sufijo "-ano") y que tiene un grupo hidroxilo (-OH) unido (por el sufijo "-ol").
La palabra "etilo" fue creada en 1834 por el químico alemán Justus von Liebig. Viene de la palabra francesa "éter" (que significa una sustancia que se evapora fácilmente) y de la palabra griega "hylé" (que significa sustancia). El nombre de etanol se adoptó oficialmente en una conferencia en Ginebra, Suiza, en 1892.
Historia del Etanol
Los seres humanos han usado el etanol desde la prehistoria. Se han encontrado restos de bebidas con etanol de hace 9000 años en China. Esto muestra que ya se usaba en la época neolítica. El químico persa Al-Razi (865-925) fue quien logró aislarlo en una forma más pura. Los químicos de esa época lo llamaban aqua vitae, que significa "agua de vida".
Otros científicos importantes en el desarrollo de las técnicas de destilación fueron Geber y Al-Kindi. En escritos de Geber (721-815) se mencionan los vapores que se encienden al hervir el vino. Al-Kindi (801-873) describió claramente cómo destilar el vino.
En 1796, Johann Tobias Lowitz obtuvo etanol puro. Lo hizo destilando etanol y filtrándolo con carbón activado.
Antoine Lavoisier describió el etanol como un compuesto de carbono, hidrógeno y oxígeno. En 1808, Nicolas Théodore Saussure determinó su fórmula química. Cincuenta años después, A. Scott Coupe publicó la estructura del etanol. Fue uno de los primeros compuestos a los que se les conoció su estructura química.
El etanol se pudo crear de forma artificial en 1826. Esto fue gracias a los trabajos de Henry Hennel en Gran Bretaña y S.G. Sérullas en Francia. En 1828, Michael Faraday preparó etanol usando un proceso similar al que se usa hoy en la industria.
En Estados Unidos, el etanol se usó como combustible para lámparas en 1840. Sin embargo, un impuesto durante la guerra civil estadounidense hizo que su uso fuera muy caro. Este impuesto se quitó en 1906. A partir de 1908, los automóviles Ford Model T podían funcionar con etanol.
Medición del Etanol en Líquidos
La cantidad de etanol en un líquido se mide con la graduación alcohólica. También se le llama grado alcohólico volumétrico. Se abrevia como "volumen" o "graduación".
Antes, la unidad era el "grado alcohólico" y se ponía con un símbolo de grado (°). Ahora se usa un porcentaje, como "Volumen" o "Vol.". Ambas formas significan lo mismo.
Propiedades Físicas del Etanol
El etanol es un líquido que se evapora fácilmente y no tiene color. Tiene un olor muy fuerte y especial. Cuando se quema, produce una llama azul que no siempre se ve bien con la luz normal.
Las propiedades del etanol se deben principalmente a su grupo hidroxilo y a su cadena corta de carbono. El grupo hidroxilo permite que el etanol forme enlaces de hidrógeno. Esto lo hace más espeso y menos volátil que otros compuestos similares.
El etanol es un disolvente muy útil. Se mezcla bien con agua y con muchos otros disolventes orgánicos. También se mezcla con hidrocarburos ligeros.
A diferencia de otros alcoholes con cadenas más largas, el etanol se mezcla muy bien con el agua. Cuando se mezclan etanol y agua, el volumen final es menor que la suma de los volúmenes iniciales. Por ejemplo, si mezclas un volumen de etanol con un volumen de agua, obtendrás menos de dos volúmenes de la mezcla. Al mezclar etanol y agua, se libera calor.
El etanol y el agua forman una mezcla especial llamada mezcla azeotrópica. Esto ocurre cuando la mezcla tiene aproximadamente 89% de etanol y 11% de agua. Esta mezcla hierve a una temperatura constante, como si fuera una sustancia pura.
El etanol puro absorbe fácilmente el agua del aire. Esto se debe a la naturaleza polar de su grupo hidroxilo. Gracias a esto, el etanol puede disolver muchos compuestos que tienen iones, como el hidróxido de sodio. Como también tiene una parte no polar, puede disolver sustancias no polares, como aceites y colorantes.
Si se añade una pequeña cantidad de etanol al agua, la tensión superficial del agua disminuye mucho. Esta propiedad ayuda a explicar el fenómeno de las "lágrimas del vino". Cuando el vino se mueve en una copa, el etanol se evapora rápidamente. La tensión superficial del vino aumenta y las gotas se deslizan por el vidrio de una forma particular.
Las mezclas de etanol y agua con más del 50% de etanol son inflamables y se encienden fácilmente. Incluso las mezclas con menos del 50% de etanol pueden encenderse si se calientan. Un ejemplo es el "flambeado" en la cocina, donde se enciende el vapor para quemar el exceso de etanol.
El etanol es un poco más refractante que el agua. Su índice de refracción es de 1,36242.
Cuando se ingiere, el cuerpo lo transforma en acetaldehído. Esta sustancia es la que causa los efectos en el cuerpo y la sensación de malestar posterior.
Propiedades Químicas del Etanol
El etanol es un alcohol primario. Esto significa que el átomo de carbono al que está unido su grupo hidroxilo tiene al menos dos átomos de hidrógeno. La forma en que el etanol reacciona químicamente está muy relacionada con su grupo hidroxilo.
- Reacciones ácido-base. El grupo hidroxilo del etanol lo hace un poco básico, aunque es casi neutro como el agua. El pH del etanol puro es de 7,33. El etanol puede reaccionar con metales como el sodio para formar etóxido de sodio y liberar hidrógeno.
- Reacciones con halógenos. El etanol reacciona con ácidos que contienen halógenos, como el ácido clorhídrico, para producir compuestos como el cloruro de etilo. Estas reacciones a menudo necesitan un catalizador.
- Formación de ésteres. El etanol puede reaccionar con otros ácidos para formar ésteres y agua. Los ésteres de etilo se usan en la industria, por ejemplo, como disolventes o para dar sabor.
- Deshidratación. Ácidos fuertes pueden hacer que el etanol pierda agua. Esto puede formar éter dietílico o etileno, dependiendo de las condiciones de la reacción.
- Oxidación. El etanol puede oxidarse, primero a acetaldehído y luego a ácido acético. En el cuerpo humano, este proceso es el que causa los efectos en el organismo. En el laboratorio, se usan agentes oxidantes fuertes para esta reacción.
- Combustión. Cuando el etanol se quema, produce dióxido de carbono y agua.
- C2H5OH(g) + 3 O2(g) → 2 CO2(g) + 3 H2O(l);
Usos y Aplicaciones del Etanol
El etanol tiene muchos usos importantes:
Usos Generales
Además de su uso en algunas bebidas, el etanol se usa mucho en la industria y en la medicina. Por ejemplo, se encuentra en algunos medicamentos y productos de belleza, como perfumes.
Es un buen disolvente y se puede usar como anticongelante. También es un desinfectante eficaz. Su mejor efecto para eliminar bacterias se logra con una concentración de aproximadamente el 70%. Para evitar que se ingiera, el etanol que se usa como desinfectante suele mezclarse con otras sustancias.
Industria Química
La industria química usa el etanol como base para crear muchos productos. Algunos ejemplos son el acetato de etilo, que es un disolvente para pegamentos y pinturas, y el éter dietílico.
También se aprovechan sus propiedades para desinfectar.
Como Combustible
Etanol (combustible) El etanol se usa como combustible en la industria y en los hogares. En algunos países, se usa cada vez más en automóviles para ayudar a reducir la contaminación. Estudios indican que su uso en vehículos puede disminuir la emisión de gases que afectan el clima.
Mezclado con alcohol metílico, se usa como combustible en algunos mecheros de laboratorio. Por eso se le llama "alcohol de quemar".
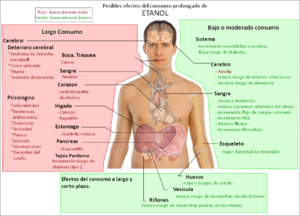
Efectos del Etanol en el Cuerpo
El etanol afecta el sistema nervioso central. Puede causar sensaciones de alegría, desinhibición, mareos, sueño y confusión. También puede hacer que los reflejos disminuyan. Con cantidades mayores, puede ralentizar los movimientos, dificultar la coordinación y causar problemas de visión.
En algunas personas, puede aumentar la irritabilidad. El consumo de grandes cantidades de etanol puede llevar a una intoxicación, que luego causa malestar. Dependiendo de la cantidad, el etanol puede provocar pérdida del conocimiento o incluso ser muy peligroso para la vida. Como el etanol afecta la capacidad de pensar con claridad, puede llevar a tomar decisiones arriesgadas.
La toxicidad del etanol se debe en gran parte a las sustancias en las que se transforma en el cuerpo, como el acetaldehído y el ácido acético. El uso continuo puede causar problemas de salud en órganos importantes.
Otros alcoholes, como el metanol, son mucho más peligrosos que el etanol. El metanol se transforma en sustancias muy tóxicas en el cuerpo, que pueden causar ceguera o ser mortales. Para tratar la intoxicación por metanol, a veces se administra etanol. Esto ayuda a que el cuerpo procese el metanol de forma más segura.
Los niños son especialmente sensibles al etanol. Se han reportado casos de bebés que sufrieron problemas graves por inhalar vapores de etanol. La ingesta en niños puede afectar su desarrollo físico y mental. Por esta razón, la venta de productos con etanol a menores de edad está prohibida. También se ha estudiado que si las madres consumen etanol durante el embarazo, sus hijos pueden tener problemas de desarrollo.
¿Cómo se detecta el Etanol?
Un método para saber la cantidad de etanol en la sangre es midiendo el vapor de etanol en el aire que se exhala. Este aire se pasa por un tubo con una sustancia que cambia de color. La longitud de la zona que cambia de color indica cuánto etanol hay en el aire.
Véase también
 En inglés: Ethanol Facts for Kids
En inglés: Ethanol Facts for Kids
- Etanol (combustible)
- Metabolismo del etanol
Enlaces externos
- En MedlinePlus hay más información sobre Etanol