Agua de mar para niños

El agua de mar o agua salada es el tipo de agua que se encuentra en los océanos y mares de la Tierra. Es salada porque contiene muchas sales minerales disueltas, aproximadamente un 3.5%. Esto significa que en cada litro de agua (1000 gramos) hay unos 35 gramos de sales. El agua de mar es más densa que el agua dulce y el agua pura. Debido a su contenido de sal, se congela a temperaturas más bajas, generalmente por debajo de los −2 °C. Los océanos guardan el 97.25% de toda el agua de nuestro planeta.
Contenido
¿Cómo se formó el agua salada?
Las primeras ideas sobre el origen de la sal
Las ideas sobre cómo el agua del mar se volvió salada comenzaron con Edmond Halley en 1715. Él pensó que la sal y otros minerales eran arrastrados desde los continentes hacia el mar por los ríos. Estos minerales venían de las rocas de la tierra que se desgastaban por la lluvia. Una vez en el océano, las sales se fueron acumulando. Halley también notó que los lagos sin salida al mar, como el mar Muerto o el mar Caspio, eran muy salados. A este proceso lo llamó "desgaste continental".
Teorías modernas sobre la salinidad del océano
La idea de Halley era en parte correcta. A esto se añade que el sodio también se liberó del fondo del océano cuando este se formó. El cloro, otro componente importante de la sal, parece venir de gases que salen del interior de la Tierra, a través de fuentes hidrotermales o volcanes.
La teoría más aceptada hoy es que la cantidad de sal en el mar ha sido bastante estable durante mucho tiempo. Los iones de sal entran y salen del interior de la Tierra en un ciclo continuo. Las sales reaccionan con las rocas del fondo oceánico, y luego, a través de procesos geológicos, vuelven a salir por las corrientes hidrotermales y los volcanes. Algunos científicos debaten si los océanos antiguos eran más salados que ahora.
¿De qué está hecha el agua de mar?
| Composición de solutos sólidos del agua de mar, cada uno expresado como porcentaje del total | |||
| Aniones | Cationes | ||
| Cloruro (Cl-) | 55.29 | Sodio (Na+) | 30.75 |
| Sulfato (SO42-) | 7.75 | Magnesio (Mg++) | 3.70 |
| Bicarbonato (HCO3-) | 0.41 | Calcio (Ca++) | 1.18 |
| Bromuro (Br-) | 0.19 | Potasio (K+) | 1.14 |
| Flúor (F-) | 0.0037 | Estroncio (Sr++) | 0.022 |
| Molécula no disociada | Ácido bórico (H3BO3) | 0.076 | |
El agua de mar es una mezcla de agua (H2O) y muchas otras sustancias. Casi dos tercios de los elementos químicos naturales se encuentran en el agua de mar, aunque la mayoría en cantidades muy pequeñas. Seis componentes principales, que son iones, forman más del 99% de las sustancias disueltas.
¿Qué es la salinidad?
Estudiar la composición del agua de mar es más fácil porque las proporciones de sus componentes son casi siempre las mismas. Sin embargo, la concentración total de todas las sales, llamada salinidad, puede variar mucho. La salinidad se mide generalmente en tanto por mil (‰). Como la composición es universal, la salinidad se puede calcular midiendo solo un factor, como la conductividad eléctrica o la cantidad de ion cloruro (Cl-).
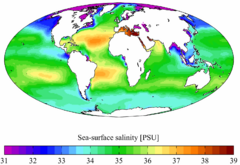
La salinidad cambia según la zona, la latitud o la profundidad. Es más alta en las zonas tropicales debido a la mayor evaporación. Es más baja cerca de la desembocadura de ríos grandes y donde llueve mucho.
El mar Rojo es el mar abierto más salado (40 ‰) porque está rodeado de zonas secas. El mar Báltico es el menos salado (6 ‰ en la superficie) debido a su poca profundidad, clima frío y muchos ríos que desembocan en él. Además, su forma casi cerrada limita el intercambio con el océano Mundial.
En lagos y mares cerrados, la salinidad varía mucho. Por ejemplo, el mar Caspio tiene solo un 12 ‰, mientras que el mar Muerto puede llegar a 330 ‰ en la superficie. La salinidad de estos mares interiores depende de si tienen salida de agua o si la evaporación es la única forma de que el agua se vaya. Por eso, el lago Victoria, que es similar al mar Muerto en origen, es de agua dulce y es la fuente principal del río Nilo.
Las diferencias de salinidad y temperatura en el agua crean diferencias de densidad. Estas diferencias son las que impulsan las grandes corrientes oceánicas, conocidas como circulación termohalina.
Desde que Edmond Halley lo propuso en 1715, se sabe que la salinidad del agua de mar se debe a una salinización gradual. Esta salinización se estabilizó hace mucho tiempo, gracias a que los ríos aportan sales de las rocas continentales. La salinidad no ha aumentado en miles de millones de años debido a la acumulación de sal en los sedimentos. Hoy se cree que gran parte del sodio proviene de las mismas erupciones volcánicas que ayudaron a formar la hidrosfera.
¿Qué es la conductividad eléctrica?
El agua de mar conduce muy bien la electricidad. Esto se debe a la polaridad del agua y a la gran cantidad de iones disueltos.
Las sales en el agua se separan en iones. Un ion es un átomo con carga eléctrica, positiva o negativa, que puede intercambiar electrones. La conductividad cambia principalmente con la temperatura y la salinidad. A mayor salinidad, mayor conductividad. Por eso, midiendo la conductividad y controlando la temperatura, se puede saber la salinidad.
¿Qué tan densa es el agua de mar?
La densidad del agua de mar es una de sus características más importantes. Sus cambios causan las corrientes marinas. La densidad se calcula usando una fórmula internacional establecida por la UNESCO. La densidad del agua de mar típica (con 3.5% de sales) es de aproximadamente 1.02819 kg/l a -2 °C, y disminuye ligeramente a temperaturas más altas.
¿Cuál es el pH del agua de mar?
El agua del océano es un poco alcalina. Su valor de pH está entre 7.5 y 8.4. Este valor puede cambiar con la temperatura (si sube, el pH baja y se vuelve más ácido), la salinidad, la presión o profundidad, y la actividad de los seres vivos marinos.
¿Qué gases hay disueltos en el agua de mar?
Los gases disueltos en el agua de mar son los mismos que los del aire, pero en diferentes proporciones. La temperatura y la salinidad afectan la cantidad de gases que se pueden disolver: si aumentan, se disuelven menos gases. Otros factores son la actividad de los seres vivos y las reacciones químicas con las sales disueltas, como el ion bicarbonato (HCO3-). La cantidad y composición de los gases disueltos varían con la profundidad.
En las aguas superficiales del océano, los gases disueltos suelen ser 64% nitrógeno (N2), 34% oxígeno (O2) y 1.8% dióxido de carbono (CO2). La cantidad de dióxido de carbono es mucho mayor que en el aire (0.04%). El oxígeno es más abundante en la superficie, donde las plantas marinas producen mucho oxígeno. Suele haber menos oxígeno a unos 400 metros de profundidad, donde la luz no llega para la fotosíntesis y hay muchos organismos que lo consumen.
¿Cómo se puede beber el agua de mar?
Los científicos han inventado muchos métodos para quitarle la sal al agua de mar y hacerla potable. Uno de los métodos más conocidos es la destilación.
Por ejemplo, en la isla de Symi, en Grecia, sus 4083 habitantes obtienen toda su agua de una planta de destilación solar que produce 15,000 litros al día. En Wrightsville Beach, Carolina del Norte (Estados Unidos), una planta usa un método de congelación para producir 750,000 litros de agua destilada cada día.
También se han desarrollado otros métodos más sencillos:
- La ósmosis inversa: el agua salada pasa a través de una membrana sintética que retiene la sal.
- La hidratación: se mezcla propano con el agua salada. El propano forma un compuesto sólido con el agua, que se separa al calentar la mezcla.
Cuando el agua no es muy salada, se puede usar otro método. En Webster, Dakota del Sur, el agua era agua salobre (con más sal de lo aceptable, pero menos que el agua de mar). Allí se instaló una planta de electrodiálisis, un proceso que es costoso si la concentración de sales es muy alta. Esta planta produce unos 950,000 litros de agua dulce al día.
La desalinización a gran escala puede generar desafíos. Por ejemplo, desalar suficiente agua para abastecer a la ciudad de Nueva York durante un año produciría unos 60 millones de toneladas de sal como residuo.
¿Por qué el agua de mar se congela a menor temperatura?
El descenso crioscópico es la razón por la que el punto de congelación de un líquido puro baja cuando se le añaden sustancias disueltas. Esto es más notable con las sales, que son iones, como las que hay en el agua de mar.
Este fenómeno tiene consecuencias importantes para el agua de mar. Cuando el agua del océano se enfría mucho, como en las regiones polares durante el invierno, el agua pura se separa y forma hielo flotante. Así es como se crea la banquisa alrededor de la Antártida o en el océano Ártico. La banquisa es una capa compacta de hielo puro, con agua salada (salmuera) llenando los pequeños espacios entre el hielo. Esta capa flota sobre agua líquida que está a menos de 0 °C (hasta un máximo de -1.9 °C para una salinidad del 3.5%).
Véase también
 En inglés: Salt water Facts for Kids
En inglés: Salt water Facts for Kids