Silicato para niños
En química, un silicato es un tipo de ion que está formado por silicio y oxígeno. Estos iones pueden tener diferentes formas, como el ortosilicato (SiO₄⁴⁻), el metasilicato (SiO₃²⁻) o el pirosilicato (Si₂O₇⁶⁻). El nombre "silicato" también se usa para las sales que contienen estos iones, como el metasilicato de sodio, o para ciertos compuestos químicos llamados ésteres.
Los iones de silicato a menudo forman moléculas muy grandes, como si fueran cadenas o anillos. Esto les permite tener una gran variedad de estructuras.
En geología y astronomía, la palabra silicato se refiere a los minerales de silicato. Estos son sólidos iónicos que contienen iones de silicato. También se usa para las rocas que están hechas principalmente de estos minerales. En este contexto, el término también incluye el dióxido de silicio (SiO₂), que es el cuarzo. Además, abarca minerales donde otros átomos, como el aluminio, reemplazan parte del silicio, formando aluminosilicatos.
Los silicatos son muy importantes porque forman la mayor parte de la corteza terrestre y el manto de la Tierra. También se encuentran en otros planetas rocosos, lunas y asteroides. Son materiales esenciales que se usan en muchas cosas, tanto naturales (como el granito o el granate) como artificiales (como el cemento Portland, la cerámica, el vidrio y el cristal líquido).
A veces, el nombre "silicato" se usa de forma más amplia para incluir iones que tienen silicio, incluso si no encajan exactamente en la fórmula general o si tienen otros átomos además del oxígeno.
Contenido
¿Cómo se forman los silicatos?
La forma tetraédrica de los silicatos
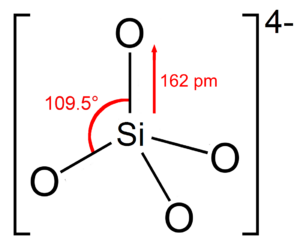
En la mayoría de los silicatos, especialmente los que se encuentran en la corteza terrestre, cada átomo de silicio está en el centro de una figura llamada tetraedro. Las cuatro esquinas de este tetraedro están ocupadas por átomos de oxígeno. Estos átomos de oxígeno se unen al silicio mediante enlaces químicos.
Estos tetraedros pueden existir solos, como en el ortosilicato (SiO₄⁴⁻). Pero también pueden unirse entre sí de varias maneras. Por ejemplo, dos o más átomos de silicio pueden compartir átomos de oxígeno para formar iones más complejos. Así se crean el pirosilicato (Si₂O₇⁶⁻) o el metasilicato en forma de anillo (Si₆O₁₈¹²⁻). Los iones de silicato muy grandes pueden formar cadenas, cadenas dobles, láminas o estructuras tridimensionales.
Normalmente, cada átomo de oxígeno que no tiene una carga negativa extra sirve como un "puente" entre dos átomos de silicio. La estructura de estos iones se describe como tetraedros de silicio unidos por sus vértices. Cada vértice es compartido por un máximo de dos tetraedros.
Silicatos con silicio en otras formas
Aunque la forma tetraédrica es la más común para el silicio, este elemento también puede unirse a más átomos. Por ejemplo, en el ion hexafluorosilicato (SiF₆²⁻), el átomo de silicio está rodeado por seis átomos de flúor en una forma llamada octaédrica. Esta misma estructura se ve en el ion hexahidroxisilicato (Si(OH)₆²⁻), que se encuentra en un mineral llamado thaumasita.
A presiones muy altas, incluso el SiO₂ (sílice) puede adoptar una forma octaédrica. Esto ocurre en el mineral stishovita, que es una forma muy densa de sílice. Se encuentra en el manto inferior de la Tierra y también se forma por el impacto de meteoritos.
¿Qué propiedades químicas tienen los silicatos?
Los silicatos sólidos suelen ser muy estables.
Algunos silicatos, como los de sodio, son bastante solubles en agua. Estos forman diferentes hidratos sólidos cuando se cristalizan de una solución. Los silicatos de sodio solubles son importantes en la industria y en el hogar. Sin embargo, la mayoría de los silicatos, especialmente los que tienen estructuras poliméricas grandes, no se disuelven mucho en agua en condiciones normales.
Reacciones de los silicatos
Los iones de silicato son como las "bases" de los ácidos silícicos. Por ejemplo, el ortosilicato se puede ver como el ácido ortosilícico al que se le han quitado cuatro protones. Los ácidos silícicos son generalmente muy débiles y no se pueden obtener en su forma pura. En soluciones acuosas, existen como mezclas de iones más grandes y parcialmente cargados, en un equilibrio constante.
Este equilibrio puede cambiar hacia la formación de iones más grandes si aumenta la cantidad de silicato o si el medio se vuelve más ácido. Por ejemplo, el ion ortosilicato es la forma principal de sílice disuelta en el agua de mar. En concentraciones más altas o con un pH bajo, predominan los iones poliméricos (más grandes).
En casos extremos, los iones de silicato se unen para formar una red tridimensional de tetraedros de silicio. La mayoría de los átomos de oxígeno actúan como puentes entre ellos. Esto forma alguna variedad de sílice, como el gel de sílice, mezclado con agua.
¿Cómo se detectan los silicatos?
Los iones de silicato en una solución reaccionan con iones de molibdato para producir complejos amarillos llamados silicomolibdato. Esta reacción permite detectar la presencia de silicatos. Los silicatos más pequeños reaccionan más rápido que los más grandes.
Formación de zeolitas y geopolímeros
La forma en que se comportan los silicatos solubles es importante para entender cómo se forman los minerales en la naturaleza (biomineralización) y cómo se crean los aluminosilicatos artificiales. Un ejemplo son los zeolitas, que son catalizadores muy importantes en la industria.
Junto con los iones de aluminato, los silicatos solubles también son clave en la formación de los geopolímeros. Los geopolímeros son un tipo de aluminosilicatos que no tienen una forma cristalina definida. Su producción requiere menos energía que la del cemento Portland común. Por eso, los cementos geopolímeros podrían ayudar a reducir las emisiones de dióxido de carbono (CO₂) a la atmósfera y a combatir el calentamiento global.
¿Cómo se clasifican los silicatos en los minerales?
Los geólogos solían pensar que los silicatos de la Tierra eran sales de ácido silícico que se formaban al disolver dióxido de silicio. Ahora, los ven como estructuras químicas que resultan de la combinación de oxígeno y silicio (o incluso aluminio en los aluminosilicatos). Estos forman tetraedros (Si,Al)O₄ que se unen entre sí compartiendo átomos de oxígeno o a través de catiónes (como el magnesio, hierro o aluminio).
Los silicatos se pueden clasificar de varias maneras. Las dos clasificaciones más usadas en mineralogía se basan en cómo se unen los tetraedros:
- La clasificación topoquímica (de Machatski-Bragg) se basa en la secuencia de los tetraedros. En esta, el silicio y el aluminio pueden reemplazarse mutuamente.
- La clasificación topológica (de Zoltai) se basa en la secuencia de tetraedros que tienen cualquier catión en su centro.
Las subcategorías de estas dos clasificaciones son las mismas y, en la mayoría de los casos, el resultado final también lo es. Sin embargo, en los aluminosilicatos que tienen tetraedros con cationes diferentes al silicio y al aluminio, las dos clasificaciones pueden ser distintas.
Los principales grupos de silicatos son:
- Nesosilicatos (u ortosilicatos): Los tetraedros no comparten vértices entre sí. Ejemplos: circón, olivinos, granates.
- Nesosubsilicatos: Similar a los nesosilicatos, pero la estructura también incluye iones que no son parte de los tetraedros. Ejemplos: cianita, andalucita, sillimanita, estaurotida, topacio, titanita.
- Sorosilicatos: Dos tetraedros comparten un vértice y forman un grupo [Si₂O₇]⁶⁻. Ejemplos: epidotas, melilita, thortveitita, hemimorfita.
- Ciclosilicatos: La estructura está formada por anillos aislados de 3, 4 o 6 tetraedros. Ejemplos: turmalina, berilo, cordierita, dioptasa.
- Inosilicatos: Los tetraedros se asocian en cadenas o cintas. Ejemplos: piroxenos, anfíbols.
- Filosilicatos: Los tetraedros comparten tres de sus cuatro vértices y forman una lámina bidimensional. Ejemplos: grupo de la clorita, micas, talco, pirofilita, serpentina, caolinita.
- Tectosilicatos: Todos los vértices de los tetraedros son compartidos. Ejemplos: cuarzo, tridimita, cristobalita, feldespatos, feldespatoides, zeolitas.
¿Por qué son importantes los silicatos en el espacio?
Algunas estrellas que están rodeadas de "polvo" frío (a menos de 1500 Kelvin) tienen granos de polvo hechos de silicatos. Su presencia se detecta por unas líneas especiales en el espectro de luz infrarrojo.
El tipo de silicato, la forma de los granos de polvo y la presencia de otros compuestos (como el hielo) dan información sobre las condiciones físico-químicas de esos lugares en el espacio.
Los silicatos se encuentran a menudo alrededor de estrellas jóvenes y estrellas más viejas. Son muy comunes en los discos de acreción y en las capas que rodean a las estrellas. Además, los silicatos son los componentes principales de los planetas rocosos de nuestro Sistema Solar: Venus, la Tierra, Marte y, en menor medida, Mercurio.
¿Cómo influyen los silicatos en el clima de la Tierra?
Sabemos que el clima afecta cómo se desgastan las rocas. También existen ciclos donde los compuestos de la erosión de las rocas cambian el ciclo del dióxido de carbono (CO₂) y el carbono en el océano, lo que a su vez afecta el clima.
El lavado de rocas ricas en silicatos ha aumentado mucho debido a las actividades humanas, como la agricultura, la silvicultura, la gestión del suelo y los incendios. La lluvia ácida y la acidificación del agua dulce también aceleran la disolución de rocas y suelos. Estos fenómenos contribuyen a la degradación de los suelos, pero también ayudan a la formación de rocas carbonatadas en los océanos. Esto significa que el CO₂ de la atmósfera se transfiere a la litosfera (la parte rocosa de la Tierra), actuando como un "sumidero de carbono".
La erosión de las rocas es importante para el ciclo del carbono en el contexto del cambio climático. Por eso, se ha creado un mapa mundial de los tipos de rocas para entender mejor este proceso. Este mapa se combinó con modelos del ciclo del CO₂ para calcular cuánto CO₂ de la atmósfera es "consumido" por las rocas al desgastarse. También se evaluó la cantidad de alcalinidad que los ríos aportan al océano. Se ha visto que el desgaste de las rocas ha variado mucho en el pasado, dependiendo de las fases glaciares e interglaciares de los paleoclimas. Las rocas de silicato, como las pizarras y los basaltos, parecen tener una gran influencia en la cantidad de CO₂ que se elimina de la atmósfera por este proceso.
Véase también
 En inglés: Silicate Facts for Kids
En inglés: Silicate Facts for Kids
- Reacción álcali-sílice
- Ciclo del carbono
- Ciclo carbonato-silicato
- Acidificación del océano