Peróxido para niños
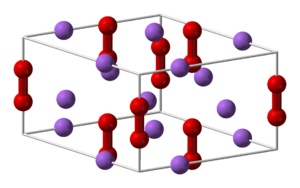
Los peróxidos son un tipo especial de sustancias químicas que tienen algo único en su estructura: dos átomos de oxígeno unidos entre sí. En estas sustancias, el oxígeno tiene un estado de oxidación de -2. La forma general de un peróxido es un metal unido a un grupo O22-.
Los peróxidos suelen ser muy buenos para "oxidar" otras sustancias. Esto significa que pueden quitar electrones a otras moléculas. Sin embargo, si se encuentran con sustancias muy oxidantes, ellos mismos pueden "reducirse" y liberar oxígeno.
Es importante saber que los peróxidos pueden ser peligrosos. Si entran en contacto con materiales que se queman fácilmente, como la madera o el papel, pueden causar incendios o incluso explosiones.
Los peróxidos son muy útiles en la industria. Se usan mucho para blanquear cosas, como la ropa en los detergentes (a veces se les llama "oxígeno activo") o para aclarar el pelo. También son importantes en la industria química para crear nuevas sustancias o como pasos intermedios en la fabricación de productos. Incluso se usan en la medicina.
El peróxido de hidrógeno (H2O2), que conoces como agua oxigenada, es el peróxido más importante. Cada año se producen más de 2 millones de toneladas de esta sustancia.
Contenido
- ¿Cómo se descubrieron los peróxidos?
- ¿Dónde se encuentran los peróxidos?
- ¿Cómo se fabrican los peróxidos?
- Peróxidos inorgánicos
- Características importantes de los peróxidos
- Usos en la química
- Estado de oxidación del oxígeno
- Cómo detectar peróxidos
- Medidas de seguridad con peróxidos
- Ver también
- Véase también
¿Cómo se descubrieron los peróxidos?
En el año 1811, un científico llamado Thénard usó un peróxido de bario para crear una sustancia que no se conocía antes. La llamó "agua oxidada", y hoy la conocemos como peróxido de hidrógeno.
Durante muchos años, los científicos estudiaron el peróxido de hidrógeno y sus compuestos. Pronto se dieron cuenta de que podía blanquear las cosas. Al principio, no se podía usar mucho en la industria porque era difícil producirlo puro y concentrado.
La primera fábrica para producir peróxido de hidrógeno se construyó en Berlín en 1873. Más tarde, se descubrió una forma mejor de producirlo usando electrólisis (pasar electricidad a través de una solución). La primera fábrica que usó este método se abrió en 1908.
En la década de 1930, se desarrolló un proceso llamado "proceso de la antraquinona", que es el que se usa principalmente hoy en día. Gracias a estos avances, la producción de peróxido de hidrógeno creció muchísimo: de 35.000 toneladas en 1950 a 2.700.000 toneladas en 1998.
¿Dónde se encuentran los peróxidos?
En la naturaleza
Los peróxidos suelen reaccionar muy fácilmente, por eso no se encuentran muchos en la naturaleza. El peróxido de hidrógeno es una excepción, ya que se encuentra de forma natural en el agua de ríos, lagos y mares, así como en el aire. Se forma por la acción de la luz o de sustancias naturales en el agua.
También existen dos minerales que contienen peróxido: la studtita y la metastudita. Estos minerales son peróxidos de uranilo. Se forman cuando el agua reacciona con la radiación de uranio.
¿Cómo se fabrican los peróxidos?
El peróxido más conocido y el punto de partida para hacer otros peróxidos es el peróxido de hidrógeno (H2O2). Hoy en día, se obtiene principalmente mediante un proceso llamado autooxidación de naftohidroquinona. Antes, se usaba la formación de peróxido de bario o la hidrólisis de persulfatos.
Muchas sustancias orgánicas pueden convertirse en hidroperóxidos si se exponen a la luz y al oxígeno del aire. Esto es especialmente peligroso con los éteres, ya que forman peróxidos muy fácilmente. Estos peróxidos pueden acumularse y causar explosiones muy fuertes, especialmente si se intenta destilar el éter. Por eso, en los laboratorios, antes de destilar grandes cantidades de estos líquidos, se debe comprobar si tienen peróxidos usando un papel especial con yoduro de potasio y almidón. Si el papel se pone azul oscuro, significa que hay peróxidos.
Peróxidos inorgánicos
Los peróxidos inorgánicos se dividen en dos grupos: las sales de peróxido iónicas y los ácidos peróxidos inorgánicos. En las sales iónicas, los peróxidos de metales alcalinos y metales alcalinotérreos son muy importantes. El peróxido de hidrógeno es el más conocido de los peróxidos covalentes.
Fabricación de peróxidos
Peróxidos iónicos
Los peróxidos de metales alcalinos (excepto el peróxido de litio) se pueden hacer reaccionando el metal directamente con oxígeno.
- Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \mathrm{2\ M\ +\ O_2\longrightarrow\ M_2O_2}
- M = Metal alcalino.
El peróxido de litio se fabrica haciendo reaccionar hidróxido de litio con peróxido de hidrógeno.
Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \mathrm{2\ LiOH\ +\ H_2O_2\longrightarrow\ Li_2O_2\ +2\ H_2O}
El peróxido de bario, que se usaba antes para producir peróxido de hidrógeno, se obtiene oxidando óxido de bario a altas temperaturas.
Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \mathrm{2\ BaO\ +\ O_2\ \xrightarrow {500 ^\circ C}\ \ \ 2\ BaO_2}
Peróxidos covalentes
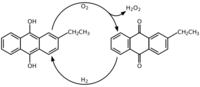
El método más común para fabricar peróxido de hidrógeno es el proceso de la antraquinona. En este proceso, una sustancia llamada antraquinona se combina con hidrógeno y luego se oxida con oxígeno, produciendo peróxido de hidrógeno.
- Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \mathrm{H_2\ +\ O_2\longrightarrow\ H_2O_2}
No es posible fabricar peróxido de hidrógeno directamente a partir de sus elementos a gran escala.
Muchos ácidos minerales que contienen peróxido se pueden fabricar mediante un proceso eléctrico llamado oxidación anódica.
Características de los peróxidos
Cuando se añade un ácido diluido a las sales de peróxido, se libera peróxido de hidrógeno.
- Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \mathrm{Na_2O_2\ +\ 2\ H_2O\ \xrightarrow {H_3O^+}\ \ 2\ NaOH\ +\ H_2O_2}
La hidrólisis ácida del peróxido de sodio produce sosa cáustica y peróxido de hidrógeno.
Si reaccionan con agua o se calientan mucho, las sales de peróxido pueden liberar oxígeno.
- Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \mathrm{2\ Na_2O_2\ + 2\ H_2O\longrightarrow\ 4\ NaOH\ +\ O_2}
- La hidrólisis de peróxido de sodio produce hidróxido de sodio y oxígeno.
Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): mathrm{2\ Na_2O_2\ \xrightarrow {\Delta T}\ \ 2\ Na_2O\ +\ O_2}
- La termólisis (descomposición por calor) de peróxido de sodio produce óxido de sodio y oxígeno.
Usos de los peróxidos
Los peróxidos son agentes oxidantes muy fuertes y se usan para oxidar otras sustancias.
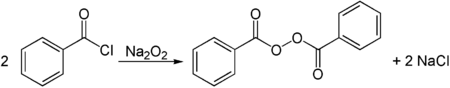
Los peróxidos de metales alcalinos se pueden usar para fabricar peróxidos orgánicos. Por ejemplo, el peróxido de sodio reacciona con cloruro de benzoilo para obtener peróxido de dibenzoilo.
Muchos peróxidos inorgánicos se usan como agentes blanqueadores en la industria textil y en la industria papelera. Como se buscan procesos de blanqueo más amigables con el medio ambiente, el uso de peróxidos ha aumentado mucho, reemplazando a los blanqueadores con cloro. En casa, se usan en detergentes. Antes se usaban perboratos, pero ahora se usan más los percarbonatos. El nombre del detergente Persil, por ejemplo, viene de las palabras Perborato y silicato.
Algunas sales de peróxido pueden liberar oxígeno cuando reaccionan con dióxido de carbono. Esto se usa en generadores de oxígeno, como los que se encuentran en aparatos de respiración, submarinos o cápsulas espaciales. Así, se elimina el dióxido de carbono que exhalamos y se produce el oxígeno que necesitamos. Generalmente se usa peróxido de sodio, pero en las cápsulas espaciales se prefiere el peróxido de litio porque es más ligero y produce más oxígeno por su peso.
Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): mathrm{2\ Na_2O_2\ +\ 2\ CO_2\longrightarrow\ 2\ Na_2CO_3\ +\ O_2} Reacción del peróxido de sodio con dióxido de carbono para formar carbonato de sodio y oxígeno.
Históricamente, el peróxido de bario se usaba para obtener oxígeno puro del aire. Se formaba peróxido de bario a 500 °C y luego, al calentarlo a más de 700 °C, liberaba oxígeno puro.
Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \mathrm{2\ BaO\ +\ aire\ \xrightarrow {500 ^\circ C}\ \ 2\ BaO_2\ \xrightarrow {700 ^\circ C}\ 2\ BaO +\ O_2\ (puro)}
El Peróxido de calcio (CaO2) se usa para airear suelos y lodos en estanques. En Estados Unidos, también se usa como aditivo alimentario para hacer que la masa sea más esponjosa.
Características importantes de los peróxidos
El enlace entre los dos átomos de oxígeno en los peróxidos es un poco inestable. Por eso, los peróxidos son muy reactivos y pueden actuar como oxidantes o como reductores. También pueden formar "radicales", que son moléculas muy reactivas.
Algunos peróxidos son muy peligrosos porque pueden causar incendios y explosiones. Por eso, se recomienda guardarlos por separado para evitar que reaccionen con otras sustancias.
Usos en la química
Las aplicaciones de los peróxidos son muy variadas. Se usan en la peluquería para aclarar el pelo y en la industria química para obtener epóxidos, en reacciones de oxidación, o para endurecer poliésteres. También se usan en la fabricación de glicerol. El ácido peroxi-trifluoroacético es un desinfectante muy potente y se usa en la industria farmacéutica. En odontología, se usa para blanquear los dientes en geles o bandas.
Estado de oxidación del oxígeno
En los peróxidos, el estado de oxidación del oxígeno es -2.
Cómo detectar peróxidos
Los peróxidos pueden detectarse de varias maneras. Por ejemplo, dan un color anaranjado con soluciones de óxido de titanio en ácido sulfúrico concentrado.
Con dicromato de potasio, forman un compuesto azul llamado peróxido de cromo (VI), que se puede extraer con éter etílico.
Medidas de seguridad con peróxidos
Los peróxidos son compuestos inestables y pueden explotar, especialmente si están muy concentrados o a altas temperaturas. Además, son inflamables y pueden reaccionar con materiales que se queman fácilmente, como el algodón o la celulosa, causando incendios. Por eso, es muy importante seguir estas medidas de seguridad al trabajar con ellos:
- El calor y la luz pueden hacer que los peróxidos se descompongan. Por eso, deben guardarse en recipientes frescos y que no dejen pasar la luz.
- Sustancias como el éter dietílico o el tetrahidrofurano (THF) pueden formar peróxidos si se exponen al aire. Deben guardarse en frascos oscuros y con hidróxido sódico.
- Si sospechas que hay peróxidos en una solución, compruébalo antes de calentarla o concentrarla.
- Las pequeñas cantidades de peróxidos que se derramen deben ser eliminadas añadiendo sustancias que los "reduzcan", como el sulfato ferroso. Solo después de esto se puede limpiar la zona de forma segura.
En la industria, la manipulación de peróxidos requiere muchas medidas de seguridad. Se producen en "celdas" especiales (estructuras de hormigón con ventanas de aluminio que se abren en caso de explosión para liberar la presión). También se usan zanjas llenas de agua que pueden inundarse si hay una fuga. Después de la producción, los peróxidos deben transportarse rápidamente a un lugar de almacenamiento refrigerado.
Ver también
- Peróxido de hidrógeno
- Peróxido de acetona
- Peróxido de benzoilo
- Superóxido
Véase también
 En inglés: Peroxide Facts for Kids
En inglés: Peroxide Facts for Kids