Aluminio para niños
Datos para niños Magnesio ← Aluminio → Silicio |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Aluminio en lámina.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Aluminio, Al, 13 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Metales del bloque p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 13, 3, p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 26,9815386(8) u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Ne] 3s2 3p1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Mohs | 2,80 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones por nivel | 2, 8, 3 (imagen) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | Plateado | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio medio | 125 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 1,61 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico (calc) | 143.1 pm (radio de Bohr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 118 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | 3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Óxido | Anfótero | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª energía de ionización | 577,5 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.ª energía de ionización | 1816,7 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3.ª energía de ionización | 2744,8 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4.ª energía de ionización | 11 577 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5.ª energía de ionización | 14 842 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6.ª energía de ionización | 18 379 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7.ª energía de ionización | 23 326 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 8.ª energía de ionización | 27 465 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 9.ª energía de ionización | 31 853 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 10.ª energía de ionización | 38 473 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líneas espectrales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Sólido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | 2698,4 kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 933,47 K (660 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | 2743 K (2470 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de vaporización | 273 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | 10,79 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión de vapor | 2,42 × 10-6 Pa a 577 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volumen molar | 10,00×10-6 m3/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | cúbica centrada en las caras | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor específico | 897 J/(kg·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad eléctrica | 37,7 × 106 S/m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 237 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo elástico | 70 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido | 6400 m/s a 293,15 K (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del aluminio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El aluminio es un elemento químico con el símbolo Al y el número atómico 13. Es un metal que no es magnético. Es el tercer elemento más común en la corteza terrestre. Los compuestos de aluminio forman el 8% de la corteza de la Tierra. Se encuentran en la mayoría de las rocas, plantas y animales. En la naturaleza, se halla en muchos silicatos como los feldespatos y las micas. Este metal se obtiene principalmente de un mineral llamado bauxita. Primero se convierte en alúmina y luego en aluminio puro mediante un proceso especial.
El aluminio tiene una combinación de propiedades que lo hacen muy útil. Es ligero, con una densidad de 2698,4 kg/m³, y es muy resistente a la corrosión. Si se mezcla con otros metales (se hacen aleaciones), su resistencia puede aumentar mucho. Es un buen conductor de la electricidad y del calor. Además, es fácil de trabajar y es bastante económico. Por estas razones, desde mediados del siglo XX, es el metal más usado después del acero.
Fue descubierto por primera vez en 1825 por el científico danés H. C. Ørsted. El mayor desafío para obtenerlo es la gran cantidad de energía eléctrica que se necesita. Sin embargo, esto se compensa porque es muy fácil de reciclar, dura mucho tiempo y su precio es estable.
Contenido
- Propiedades del Aluminio
- ¿Cómo se Descubrió el Aluminio?
- Estructura Atómica del Aluminio
- Compuestos de Aluminio
- Usos y Aplicaciones del Aluminio
- ¿Cómo se Produce el Aluminio?
- Aleaciones de Aluminio: Más Fuertes y Útiles
- Procesos de Fabricación con Aluminio
- Protección del Aluminio: Superficies Especiales
- Seguridad y el Aluminio
- El Aluminio y los Suelos
- Véase también
- Galería de imágenes
Propiedades del Aluminio
El aluminio es un elemento muy común en la naturaleza. Solo el oxígeno y el silicio son más abundantes.
Propiedades Físicas
El aluminio es un metal ligero. Su densidad es de 2700 kg/m³. Tiene un punto de fusión bajo, de 660 °C. Su color es gris plateado y refleja bien la luz y el calor. Es un buen conductor de la electricidad y del calor.
Propiedades Mecánicas
Es un material blando, con una dureza de 2-3-4 en la escala de Mohs. Es fácil de moldear y estirar. Cuando está puro, no es muy fuerte. Sin embargo, es resistente a la corrosión. Para hacerlo más fuerte, se mezcla con otros metales. Esto permite usarlo en la fabricación de cables eléctricos y láminas delgadas. También se puede fundir, forjar y extruir.
Propiedades Químicas
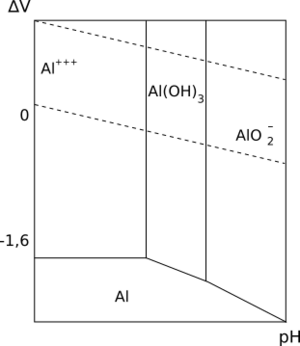
El aluminio tiene tres electrones en su capa exterior. Por eso, su estado de oxidación más común es +3. Reacciona con el oxígeno del aire formando una capa delgada de alúmina (Al2O3). Esta capa es gris y protege el metal de la corrosión. Es tan estable que se usa para extraer otros metales de sus óxidos. El aluminio se disuelve en ácido clorhídrico y en hidróxido sódico.
¿Cómo se Descubrió el Aluminio?

En la antigüedad, el aluminio se usaba en forma de una sal llamada alumbre para teñir telas y en medicina. En el siglo XIX, los científicos identificaron el elemento. El nombre "aluminum" fue propuesto por sir Humphrey Davy en 1809. Más tarde, se cambió a "aluminium" para que fuera más parecido a otros nombres de elementos.
En 1825, el físico danés Hans Christian Ørsted logró aislar las primeras muestras de aluminio. Dos años después, Friedrich Wöhler consiguió aislarlo por completo.
Al principio, extraer aluminio de las rocas era muy difícil y costoso. En el siglo XIX, el aluminio era tan caro que se consideraba un material exótico, incluso más valioso que la plata o el oro. En la Exposición Universal de 1855, se mostraron barras de aluminio junto a las joyas de la corona de Francia. El emperador Napoleón III incluso tenía una vajilla de aluminio. La punta del Monumento a Washington también se hizo de aluminio en 1884.
Con el tiempo, las técnicas para obtener aluminio mejoraron. La invención de la dinamo en 1866 ayudó a generar la electricidad necesaria. En 1889, Karl Bayer patentó un método para extraer alúmina de la bauxita. Poco antes, en 1886, Paul Héroult y Charles Martin Hall crearon un proceso de extracción llamado proceso Hall-Héroult.
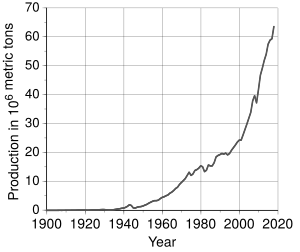
Gracias a estas nuevas técnicas, la producción de aluminio creció rápidamente. De apenas 2 toneladas en 1882, pasó a 6700 toneladas en 1900, y a millones de toneladas en el siglo XX. Esto hizo que el precio bajara y el aluminio se convirtiera en un metal común. Hoy en día, es el metal no férreo más producido. Desde 1960, el reciclaje de aluminio es muy importante, ya que cuesta mucho menos energía que producirlo desde cero.
Estructura Atómica del Aluminio
El aluminio tiene un número atómico de 13. Esto significa que tiene 13 protones en su núcleo y 13 electrones girando alrededor. Los electrones se organizan en capas.
Existen dos tipos principales de átomos de aluminio en la naturaleza, llamados isótopos: el 27Al, que es estable, y el 26Al, que es radiactivo y se descompone lentamente. El 26Al se usa para saber la edad de cosas muy antiguas, como rocas o meteoritos.
Compuestos de Aluminio
El aluminio suele formar compuestos donde tiene un estado de oxidación de +3. Cuando el aluminio está disuelto en agua, no tiene color. Sus óxidos, hidróxidos y fluoruros no se disuelven en agua.
Usos y Aplicaciones del Aluminio
El aluminio es uno de los metales más importantes y versátiles en la industria. Se usa puro, mezclado con otros metales (aleaciones) o en compuestos.
En la Vida Diaria
- Cuando es puro, se usa para fabricar espejos.
- Su uso más conocido es el papel aluminio, que son láminas muy finas para envolver alimentos.
- También se usa en la fabricación de latas de bebidas y envases como los tetrabriks.
- Está presente en utensilios de cocina y herramientas.
En la Industria
- Es un buen conductor eléctrico, a veces compite con el cobre en cables.
- En la aeronáutica, su bajo peso es clave para fabricar aviones, lo que reduce el consumo de combustible.
- En los tendidos eléctricos, su ligereza permite separar más las torres de alta tensión.
- Mezclado con otros metales, se usa para construir estructuras en edificios y piezas de vehículos.
- Se emplea en la soldadura aluminotérmica y como combustible en algunas reacciones.
- Por su buen comportamiento a bajas temperaturas, se usa en contenedores para criogenia (temperaturas muy bajas).
- La alúmina, que es óxido de aluminio, se usa para hacer corindón, una gema que puede ser rubí (rojo) o zafiro (azul). También se usa como material abrasivo para pulir metales.
- Los compuestos de aluminio se usan en la fabricación de cerámica, vidrio, para purificar agua y en la producción de papel.
¿Cómo se Produce el Aluminio?

El aluminio es muy abundante en la corteza terrestre, pero es costoso de obtener. La producción mundial es de millones de toneladas al año, con China y Rusia como los mayores productores. Una parte importante de la producción viene del reciclaje.
De la Bauxita al Aluminio Puro
La materia prima para obtener aluminio es la bauxita. Los principales lugares donde se encuentra bauxita son el Caribe, Australia, Brasil y África. La bauxita es rica en aluminio.
El proceso para obtener aluminio tiene dos fases:
- Se extrae la alúmina (óxido de aluminio) de la bauxita, en un proceso llamado proceso Bayer.
- Se extrae el aluminio puro de la alúmina mediante electrólisis.
Para que te hagas una idea, cuatro toneladas de bauxita producen dos toneladas de alúmina, y de esas, se obtiene una tonelada de aluminio. El proceso Bayer implica triturar la bauxita y lavarla con una solución caliente. Luego, la solución se enfría y se calienta de nuevo para obtener la alúmina.
La alúmina tiene un punto de fusión muy alto. Para poder usar la electrólisis, se disuelve en un baño especial. La electrólisis usa mucha energía eléctrica, lo que hace que el aluminio sea caro de producir. Por eso, se buscan formas más económicas de obtenerlo. El aluminio que se obtiene es muy puro. Después, se puede purificar más o mezclar con otros metales.
El Reciclaje del Aluminio
El aluminio es 100% reciclable sin perder sus propiedades. Reciclar aluminio es muy importante porque solo se necesita el 5% de la energía que se usa para producirlo por primera vez.
El reciclaje de aluminio se hizo popular cuando se empezó a usar mucho en las latas de refrescos. El aluminio reciclado se llama "aluminio secundario", pero es igual de bueno que el aluminio nuevo.
Para reciclar, primero se clasifica la chatarra de aluminio. Luego se compacta o se fragmenta para guardarla y transportarla fácilmente. Es un material fácil de manejar porque es ligero, no se quema y no se oxida. El reciclaje de aluminio también ayuda a crear empleos.
Aleaciones de Aluminio: Más Fuertes y Útiles
El aluminio puro es blando y no muy resistente. Para mejorar estas características, se mezcla con otros elementos, como magnesio, manganeso, cobre, zinc y silicio. A veces se añaden también titanio y cromo.
La primera aleación de aluminio famosa fue el duraluminio, que contenía cobre. Hoy en día, las aleaciones de aluminio se clasifican en series (de la 1000 a la 8000) según el elemento principal que se le añade. Algunas de estas aleaciones se tratan con calor para hacerlas aún más resistentes.
- Serie 1000: Es aluminio casi puro, usado para láminas delgadas.
- Serie 2000: Contiene cobre, muy resistente, ideal para estructuras de aviones.
- Serie 3000: Contiene manganeso, es fuerte y fácil de trabajar.
- Serie 4000: Contiene silicio.
- Serie 5000: Contiene magnesio, es resistente después de un tratamiento.
- Serie 6000: Contiene silicio y magnesio, buena para perfiles y estructuras.
- Serie 7000: Contiene zinc, muy resistente, también usado en aviones.
Procesos de Fabricación con Aluminio
Extrusión: Creando Formas Largas
La extrusión es un proceso para dar forma al aluminio. Consiste en empujar el metal caliente a través de un molde para crear perfiles largos y con formas complejas. Es como exprimir pasta de dientes por un agujero.
El aluminio se calienta a unos 500 °C para que esté blando. Luego, una prensa lo empuja a través de un molde. La presión hace que el aluminio se caliente aún más y se vuelva muy maleable. Los perfiles que salen se enfrían y se estiran para que queden rectos. Después, se calientan en hornos para que adquieran la resistencia deseada.
Fundición: Moldeando Piezas
La fundición es el proceso de verter aluminio derretido en un molde. Cuando el metal se enfría y se endurece, toma la forma del molde.
Hay tres tipos principales de fundición para el aluminio:
- Fundición en molde de arena: Se usa arena para hacer el molde. Es bueno para piezas grandes o con formas muy complicadas, y para pocas unidades.
- Fundición en molde metálico: Se usan moldes de metal que se pueden reutilizar muchas veces. Es para producciones más grandes.
- Fundición por presión o inyección: El metal derretido se inyecta a alta presión en moldes metálicos. Es el método más rápido para hacer muchas piezas idénticas.
Con la fundición se pueden hacer piezas de todos los tamaños y formas, desde pequeñas partes para prótesis hasta grandes estructuras de máquinas.

Las aleaciones de aluminio para fundición suelen contener silicio para que el metal fluya mejor cuando está derretido. También se añade magnesio o cobre para aumentar la resistencia de las piezas.
Mecanizado: Dando Forma con Precisión
El mecanizado es el proceso de cortar y dar forma al aluminio usando máquinas y herramientas. Es un proceso fácil y rápido con el aluminio. Las máquinas no necesitan tanta fuerza como para cortar acero.
El aluminio es un buen conductor del calor, lo que ayuda a que el calor generado al cortar se disipe rápidamente. Su ligereza también es una ventaja.
Sin embargo, el aluminio puede pegarse a las herramientas de corte si no se usa suficiente refrigeración. Por eso, se usan herramientas especiales y líquidos de corte para que el proceso sea suave y preciso. El mecanizado rápido permite crear piezas complejas sin necesidad de fundirlas primero.
Soldadura
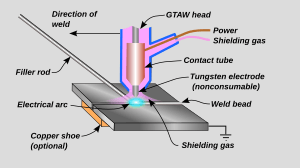
El aluminio se puede soldar de varias maneras, como la soldadura por arco eléctrico o por fricción.
- La soldadura TIG (Tungsten Inert Gas) usa un electrodo que no se derrite y un gas protector como el argón o el helio. Es muy usada para soldar aluminio de 1 a 6 mm de grosor.
- La soldadura MIG (Metal Inert Gas) usa un electrodo que sí se derrite.
Antes de soldar, es muy importante limpiar bien las piezas para quitar suciedad, grasa o óxido.
- La soldadura por fricción une piezas de aluminio sin derretirlas. Una herramienta giratoria frota las piezas, generando calor y uniéndolas firmemente. Este método es bueno para unir láminas de aluminio y produce soldaduras de alta calidad.
Doblado
Cuando se dobla una lámina de aluminio, es importante considerar la "dirección del grano". Esto se refiere a la forma en que los cristales del metal se alinearon durante su fabricación. Si se dobla en la dirección incorrecta o con un radio muy pequeño, el aluminio podría romperse.
Protección del Aluminio: Superficies Especiales
Anodizado: Una Capa Protectora Fuerte
El aluminio, al contacto con el aire, forma una capa muy fina de óxido de aluminio (Al2O3) que lo protege de la corrosión.
El anodizado es un proceso químico y eléctrico que crea una capa de óxido mucho más gruesa y protectora. Esta capa es muy resistente a los productos químicos, es dura y no conduce la electricidad. Además, es porosa, lo que permite darle colores decorativos.
Hay dos tipos de anodizado:
- Anodizados decorativos coloreados: Para dar color al aluminio.
- Anodizados de endurecimiento superficial (Anodizado duro): Crea capas muy gruesas y duras, comparables al cromo. Son muy resistentes al desgaste y a la abrasión.
Las ventajas del anodizado son:
- La capa es muy duradera y no se pela.
- Permite colorear el aluminio de muchas formas.
- No se daña con la luz del sol.
Pintura: Color y Protección
El proceso de pintura para el aluminio se llama lacado. Consiste en aplicar una capa de pintura en polvo sobre la superficie del aluminio. Las pinturas de poliéster son muy usadas por su resistencia a la luz y a la corrosión.
El lacado tiene como objetivo mejorar el aspecto y las propiedades del aluminio. El proceso incluye limpiar las piezas, aplicar la pintura en polvo con pistolas especiales y luego hornearlas para que la pintura se endurezca.
Corrosión del Aluminio
El aluminio se protege a sí mismo con una capa de óxido. Sin embargo, esta capa puede desaparecer si el aluminio entra en contacto con ciertos ácidos o soluciones muy alcalinas. También reacciona con el mercurio y sus sales.
Las aleaciones de aluminio pueden ser menos resistentes a la corrosión que el aluminio puro, especialmente si han sido tratadas con calor.
Seguridad y el Aluminio
Durante mucho tiempo, se pensó que el aluminio era completamente seguro para las personas. Por eso, se usó mucho en utensilios de cocina, envases de alimentos y papel de aluminio. Sin embargo, estudios han demostrado que la exposición a altos niveles de aluminio puede causar problemas de salud.
La exposición al aluminio puede ocurrir si:
- Se toman medicamentos con mucho aluminio.
- Se inhala polvo de aluminio en el lugar de trabajo.
- Se vive cerca de donde se extrae o procesa aluminio.
- Se comen alimentos ácidos preparados en superficies de aluminio.
Es importante saber que, aunque la exposición normal al aluminio no suele ser dañina, niveles muy altos pueden ser un problema. Si tienes dudas sobre la exposición al aluminio, es mejor consultar a un experto en salud.
El Aluminio y los Suelos
En algunos suelos del planeta, el aluminio se acumula en ciertas capas. Esto hace que esos suelos sean especiales. Por ejemplo, en los suelos tropicales y subtropicales, y en los suelos de climas fríos con bosques de pinos, hay mucha concentración de aluminio.
En estos suelos, las plantas tienen pocos nutrientes disponibles. Además, el alto contenido de aluminio puede ser tóxico para ellas. Por eso, en estas regiones, se suelen cultivar plantas que pueden crecer bien con poco alimento y que son resistentes al aluminio, como el té, el caucho y la palma de aceite.
Véase también
 En inglés: Aluminium Facts for Kids
En inglés: Aluminium Facts for Kids
- Anodizado
- Aluminosis
- Aleaciones de aluminio
- Aleaciones ligeras
- Fundición a presión
- Historia del aluminio
Galería de imágenes