Gases nobles para niños
Los gases nobles son un grupo especial de elementos químicos que tienen propiedades muy parecidas. Por ejemplo, en condiciones normales, son gases que están formados por un solo átomo (monoatómicos), no tienen color ni olor, y casi no reaccionan con otros elementos. Se encuentran en el grupo 18 de la tabla periódica.
Los seis gases nobles que encontramos en la naturaleza son el helio (He), el neón (Ne), el argón (Ar), el kriptón (Kr), el xenón (Xe) y el radón (Rn), que es radiactivo. Existe otro elemento, el oganesón (Og), que ha sido creado en laboratorios y también pertenece a este grupo, pero es tan inestable que sus propiedades aún se están estudiando.
La razón por la que los gases nobles son tan poco reactivos es que sus capas de electrones más externas están "completas". Esto significa que no necesitan ganar, perder o compartir electrones con otros átomos, lo que los hace muy estables. Por eso, es difícil que formen compuestos con otros elementos. Sin embargo, el xenón puede reaccionar con el flúor, que es un elemento muy fuerte, y a partir de ahí se han creado otros compuestos. También se han logrado algunos compuestos con kriptón.
Los gases nobles tienen puntos de fusión y ebullición muy cercanos entre sí, lo que significa que solo son líquidos en un rango muy pequeño de temperaturas, y estas temperaturas son muy, muy bajas.
El neón, argón, kriptón y xenón se obtienen del aire usando métodos especiales para enfriar el aire hasta que se vuelve líquido y luego separarlo. El helio se saca del gas natural, y el radón se obtiene de la desintegración de otros elementos como el radio. Los gases nobles se usan en muchas cosas importantes, como la iluminación, la soldadura y la exploración espacial.
Contenido
¿Cómo se descubrieron los gases nobles?
El origen del nombre "Gas Noble"
El nombre "gas noble" viene del alemán Edelgas, que significa "gas noble". Fue usado por primera vez en 1898 por Hugo Erdmann. Este nombre se parece al de "metales nobles", como el oro, que también son poco reactivos. Antes, a estos gases se les llamaba "gases inertes" o "gases raros", pero esos nombres no eran del todo correctos porque el argón, por ejemplo, es bastante común en la atmósfera terrestre.
Los primeros descubrimientos
El primer gas noble descubierto fue el helio. Esto ocurrió el 18 de agosto de 1868, cuando los científicos Pierre Janssen y Joseph Norman Lockyer lo encontraron mientras estudiaban el Sol. Lo llamaron helio por la palabra griega para el Sol, helios.
Mucho antes, en 1784, el químico Henry Cavendish ya había notado que el aire contenía una pequeña cantidad de una sustancia que no reaccionaba tanto como el nitrógeno. Un siglo después, en 1895, Lord Rayleigh descubrió que el nitrógeno del aire tenía una densidad diferente al nitrógeno creado en el laboratorio. Trabajando con William Ramsay, Lord Rayleigh pensó que el nitrógeno del aire estaba mezclado con otro gas. Hicieron un experimento y lograron aislar un nuevo elemento: el argón, que significa "inactivo" en griego.
Completando la tabla periódica
Después de descubrir el argón, se dieron cuenta de que faltaba un grupo completo de gases en la tabla periódica. Mientras buscaban el argón, Ramsay también logró aislar el helio por primera vez, calentando un mineral llamado cleveíta. En 1902, Dmitri Mendeléyev incluyó estos gases nobles en su tabla periódica como el Grupo 0.
Ramsay siguió investigando y, en 1898, descubrió el kriptón ("oculto"), el neón ("nuevo") y el xenón ("extraño"), todos nombres de origen griego. El radón fue identificado por primera vez en 1898 por Friedrich Ernst Dorn, pero no se consideró un gas noble hasta 1904, cuando se vio que tenía propiedades similares a los demás. Ese mismo año, Rayleigh y Ramsay recibieron el Premio Nobel por sus descubrimientos.
Entendiendo la estructura atómica
El descubrimiento de los gases nobles fue muy importante para entender cómo están hechos los átomos. En 1895, el químico francés Henri Moissan intentó sin éxito hacer reaccionar el flúor con el argón. Aunque no lo logró, estos intentos ayudaron a desarrollar nuevas ideas sobre la estructura atómica.
Basándose en estos experimentos, el físico danés Niels Bohr propuso en 1913 que los electrones en los átomos se organizan en capas alrededor del núcleo. En el caso de los gases nobles (excepto el helio), la capa exterior siempre tiene ocho electrones. En 1916, Gilbert N. Lewis formuló la regla del octeto, que dice que la forma más estable para un átomo es tener ocho electrones en su capa exterior. Esta configuración hace que los elementos no reaccionen con otros, ya que no necesitan más electrones.
Los primeros compuestos de gases nobles
Durante mucho tiempo se pensó que los gases nobles no podían formar compuestos. Pero en 1962, Neil Bartlett descubrió el primer compuesto químico de un gas noble, el hexafluoroplatinato de xenón. Poco después, se encontraron compuestos de otros gases nobles, como el fluoruro de radón en 1962 y el difluoruro de kriptón en 1963. El primer compuesto estable de argón se logró en el año 2000, a temperaturas muy bajas.
En 2006, científicos lograron crear el oganesson (Og), el séptimo elemento del Grupo 18.
¿Qué propiedades tienen los gases nobles?
| Propiedad | Gas noble | ||||||
|---|---|---|---|---|---|---|---|
| Número atómico | 2 | 10 | 18 | 36 | 54 | 86 | 118 |
| Nombre del elemento | Helio | Neón | Argón | Kriptón | Xenón | Radón | Oganesón |
| Densidad (kg/m³) | 0.1785 | 0.9002 | 1.7818 | 3.708 | 5.851 | 9.97 | 13.65 |
| Punto de ebullición (°C) | –268.83 | –245.92 | –185.81 | –151.7 | –106.6 | –62 | |
| Punto de fusión (°C) | –272 | –248.52 | –189.6 | –157 | –111.5 | –71 | |
Propiedades físicas
Los gases nobles tienen fuerzas de atracción muy débiles entre sus átomos, por eso sus puntos de fusión y ebullición son extremadamente bajos. Todos son gases formados por un solo átomo en condiciones normales, incluso los que tienen átomos más pesados que algunos elementos sólidos.
El helio tiene propiedades únicas: su punto de ebullición y fusión son los más bajos de cualquier sustancia conocida. Es el único elemento que puede volverse un "superfluido", un estado donde fluye sin ninguna resistencia. Además, no se puede volver sólido solo enfriándolo; necesita mucha presión y temperaturas muy bajas para solidificarse.
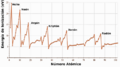
El tamaño de los átomos de los gases nobles aumenta a medida que bajamos en la tabla periódica. Esto afecta otras propiedades, como la energía necesaria para quitarles un electrón (potencial de ionización). Los gases nobles tienen los potenciales de ionización más altos de cada periodo, lo que demuestra lo estables que son sus electrones. Sin embargo, los gases nobles más pesados tienen potenciales de ionización más bajos, lo que los hace un poco más reactivos.
Propiedades químicas
| Z | Elemento | Electrones por capa |
|---|---|---|
| 2 | helio | 2 |
| 10 | neón | 2, 8 |
| 18 | argón | 2, 8, 8 |
| 36 | kriptón | 2, 8, 18, 8 |
| 54 | xenón | 2, 8, 18, 18, 8 |
| 86 | radón | 2, 8, 18, 32, 18, 8 |
| 118 | oganesón | 2, 8, 18, 32, 32, 18, 8 (predicciones) |
Los gases nobles son incoloros, inodoros (sin olor), insípidos (sin sabor) y no se queman en condiciones normales. Antes se pensaba que no podían formar compuestos, pero luego se descubrió que algunos sí lo hacen.
La clave de su estabilidad es que tienen sus capas de electrones más externas "llenas". Estos electrones son los que participan en los enlaces químicos. Como sus capas están completas, no necesitan ganar ni perder electrones, lo que los hace muy estables y poco propensos a formar enlaces. Sin embargo, los gases nobles más pesados, como el radón, tienen sus electrones exteriores menos fuertemente unidos, lo que los hace un poco más fáciles de reaccionar.
Compuestos de gases nobles
Aunque son poco reactivos, se han logrado formar muchos compuestos de gases nobles. No se han formado compuestos estables con helio y neón, pero el xenón, kriptón y argón sí pueden reaccionar, aunque con dificultad. La reactividad aumenta a medida que los átomos son más grandes: Ne < He < Ar < Kr < Xe < Rn.
En 1933, Linus Pauling predijo que los gases nobles más pesados podrían formar compuestos con el flúor y el oxígeno. Sus predicciones resultaron ser bastante acertadas. Los compuestos de xenón son los más numerosos. La mayoría de ellos tienen el átomo de xenón unido a elementos muy fuertes como el flúor o el oxígeno. Algunos de estos compuestos se usan en la síntesis química para hacer reaccionar otras sustancias.
El radón, en teoría, es más reactivo que el xenón, pero debido a su radiactividad y su corta duración, solo se han formado unos pocos compuestos con él. El kriptón es menos reactivo que el xenón, pero también se han logrado algunos compuestos. Los primeros compuestos de argón se obtuvieron en el año 2000, pero solo a temperaturas muy bajas. Hasta 2007, no se conocían moléculas estables con helio o neón que tuvieran enlaces químicos.
Los gases nobles también pueden formar compuestos donde el átomo de gas noble está "atrapado" dentro de la estructura de otras moléculas, como los clatratos o los fullerenos. Estos compuestos son útiles para estudiar la estructura de esas moléculas.
¿Dónde se encuentran y cómo se producen?
La cantidad de gases nobles en el universo disminuye a medida que sus átomos son más grandes. El helio es el segundo elemento más común en el universo, después del hidrógeno. La mayor parte del helio del universo se formó al principio del universo, y sigue aumentando gracias a las estrellas que transforman hidrógeno en helio.
En la Tierra, la situación es diferente. El helio es solo el tercer gas noble más abundante en la atmósfera. Esto se debe a que el helio es tan ligero que la gravedad de la Tierra no puede retenerlo. El helio que encontramos en la Tierra proviene de la desintegración de elementos pesados como el uranio y el torio en la corteza terrestre, y se acumula en yacimientos de gas natural.
El argón es el gas noble más abundante en la atmósfera terrestre. Se forma por la desintegración de un tipo de potasio que se encuentra en la corteza terrestre. El radón se forma en el suelo por la desintegración del radio. Puede filtrarse en los edificios a través de los cimientos y acumularse en lugares con poca ventilación. Por su radiactividad, el radón puede ser peligroso para la salud si se acumula en lugares cerrados, por lo que es importante una buena ventilación.
| Abundancia | Helio | Neón | Argón | Kriptón | Xenón | Radón |
|---|---|---|---|---|---|---|
| Sistema solar (por cada átomo de silicio) |
2343 | 2.148 | 0.1025 | 5.515 × 10−5 | 5.391 × 10−6 | – |
| Atmósfera terrestre (proporción en volumen en ppm) |
5.2 | 18.2 | 9340.0 | 1.1 | 0.09 | (0.06−18) × 10−19 |
| Roca ígnea (proporción en masa en ppm) |
3 × 10−3 | 7 × 10−5 | 4 × 10−2 | – | – | 1.7 × 10−10 |
| Gas | Precio en el 2004 (USD/m³) |
|---|---|
| Helio (grado industrial) | 4.2-4.9 |
| Helio (grado de laboratorio) | 22.3-44.9 |
| Argón | 2.70-8.50 |
| Neón | 60-120 |
| Kriptón | 400-500 |
| Xenón | 4000-5000 |
El neón, argón, kriptón y xenón se obtienen del aire. Primero se enfría el aire hasta que se vuelve líquido, y luego se separan los gases. El helio se saca del gas natural, y el radón se aísla de la desintegración de compuestos de radio. El precio de estos gases depende de lo abundantes que sean; el argón es el más barato y el xenón el más caro.
¿Para qué se usan los gases nobles?
Enfriamiento y buceo
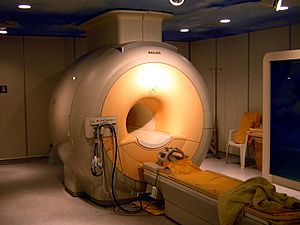
Los gases nobles tienen puntos de ebullición y fusión muy bajos, lo que los hace excelentes para enfriar cosas a temperaturas extremadamente bajas (criogenia). El helio líquido, por ejemplo, se usa para enfriar los imanes de las máquinas de imagen por resonancia magnética (MRI). El neón líquido, aunque no tan frío como el helio, también se usa para enfriar.
El helio se usa en las mezclas de gases para bucear a gran profundidad, en lugar del nitrógeno. Esto ayuda a los buzos a evitar problemas como la "narcosis de nitrógeno" (una especie de aturdimiento) y la "enfermedad por descompresión" (cuando se forman burbujas de gas en el cuerpo al subir). El argón también se usa para inflar los trajes secos de buceo.
En la industria y la iluminación
Desde el accidente del dirigible Hindenburg en 1937, el helio ha reemplazado al hidrógeno como gas para inflar dirigibles y globos, porque es ligero y no se quema.
En muchas industrias, los gases nobles se usan para crear una atmósfera inerte, es decir, sin oxígeno ni otros gases que puedan reaccionar. El argón se usa para proteger soldaduras y en la fabricación de silicio para la industria de los semiconductores. El helio se usa en la cromatografía de gases y en aparatos para medir la radiación.
Los gases nobles son muy comunes en la iluminación porque no reaccionan. El argón, mezclado con nitrógeno, se usa en las bombillas normales. El kriptón se usa en bombillas de alto rendimiento. Los gases nobles brillan con colores característicos cuando se les aplica electricidad en tubos de descarga, como los faros de neón que dan un color naranja-rojo. El xenón se usa en faros de xenón para coches y proyectores de cine, ya que su luz se parece mucho a la luz del día.
En medicina y tecnología
Los láseres de excímeros usan gases nobles, como el argón y el flúor (ArF), o el kriptón y el flúor (KrF). Estos láseres producen luz ultravioleta que permite hacer imágenes de alta precisión. Se usan en la fabricación de circuitos integrados y en cirugía láser, como la cirugía ocular.
Algunos gases nobles también se usan en la medicina. El helio a veces se usa para ayudar a respirar a pacientes con asma. El xenón se utiliza como anestésico porque es muy efectivo y el cuerpo lo elimina rápidamente, lo que permite una recuperación más veloz. El radón, que es radiactivo, se usa en tratamientos de radioterapia.
Colores de los gases nobles en tubos de descarga
- Colores producidos por los diferentes gases nobles en tubos de neón
El color de la luz que emiten los gases nobles en un tubo de descarga depende de varios factores:
- La cantidad de electricidad que se les aplica.
- La pureza del gas (incluso una pequeña cantidad de otro gas puede cambiar el color).
- El material del tubo de vidrio.
Galería de imágenes
-
El helio fue detectado por primera vez en el Sol debido a sus características de líneas espectrales.
-
Gráfico de potencial de ionización respecto al número atómico. Los gases nobles tienen el mayor potencial de ionización de cada periodo.
Véase también
 En inglés: Noble gas Facts for Kids
En inglés: Noble gas Facts for Kids