Sal (química) para niños
En química, una sal es un compuesto químico que se forma cuando iones con carga positiva (llamados cationes) se unen a iones con carga negativa (llamados aniones). Esta unión se produce mediante un enlace iónico, que es como un imán muy fuerte entre ellos.
Las sales suelen ser el resultado de una reacción química especial llamada neutralización. Esto ocurre cuando un base (que aporta el catión) y un ácido (que aporta el anión) se combinan.
En general, las sales son compuestos iónicos que forman cristales. La mayoría se disuelven bien en agua, donde sus iones se separan. Las sales suelen tener un punto de fusión alto, lo que significa que necesitan mucho calor para derretirse. También son poco duras y no se comprimen fácilmente. Cuando están derretidas o disueltas en agua, pueden conducir la electricidad.
Un ejemplo muy conocido es la sal de mesa, que usamos para cocinar. Su nombre químico es cloruro de sodio y su fórmula molecular es NaCl. Esta sal se forma de la combinación de hidróxido sódico (una base) y ácido clorhídrico (un ácido).
El científico Mijaíl Lomonósov describió las sales como "cuerpos frágiles que se disuelven en agua y permanecen transparentes; no se queman si, en su forma pura, se exponen al fuego". Mencionó muchos tipos, como el vitriolo, el alumbre y la sal común.
Contenido
¿Cómo se forman las sales?
Las sales se pueden obtener de varias maneras a través de reacciones químicas. Las más comunes son:
Reacciones de neutralización
Cuando un ácido y una base se encuentran, se neutralizan y forman una sal y, a menudo, agua.
- <chem>NH3 + HCl -> NH4Cl</chem>
- <chem>Ca(OH)2 + 2HCl -> CaCl2 + 2H2O</chem>
Reacción entre metales y ácidos
Algunos metales reaccionan con ácidos para formar una sal y liberar gas hidrógeno.
- <chem>Mg + H2SO4 -> MgSO4 + H2</chem>
- <chem>Zn + HCl -> ZnCl2 + H2</chem>
Reacción entre metales y no metales
Ciertos metales que se oxidan fácilmente pueden reaccionar con no metales oxidantes para formar sales.
- <chem>Ca + Cl2 -> CaCl2</chem>
Reacción entre bases metálicas y óxidos de no metal
Las bases de metales pueden reaccionar con formas anhidras de ácidos (óxidos de no metal).
- <chem>2NaOH + Cl2O -> 2NaClO + H2O</chem>
Reacción entre óxidos metálicos y ácidos
Los óxidos de metales también pueden reaccionar con ácidos para formar sales y agua.
- <chem>2HNO3 + Na2O -> 2NaNO3 + H2O</chem>
Reacciones de sustitución entre sales
A veces, dos sales reaccionan entre sí y forman una nueva sal que no se disuelve bien y se precipita (se asienta en el fondo).
- <chem>Pb(NO3)2(aq) + Na2SO4(aq) -> PbSO4(s) + 2NaNO3(aq)</chem>
¿Cómo se nombran las sales?
Las sales se nombran según el anión (la parte negativa) y el catión (la parte positiva) que las forman.
Sales de hidrácidos
Si la sal viene de un hidrácido (un ácido sin oxígeno), la terminación "-hídrico" del ácido cambia a "-uro" en la sal. Por ejemplo, el cloruro de sodio (NaCl) viene del ácido clorhídrico (HCl).
Sales de oxoácidos
Si la sal viene de un oxoácido (un ácido con oxígeno), las terminaciones "-oso" o "-ico" del ácido cambian a "-ito" o "-ato" en la sal. Por ejemplo, el fosfato de calcio (Ca3(PO4)2) viene del ácido fosfórico (H3PO4).
Sales ácidas
Son sales que aún tienen átomos de hidrógeno que podrían ser reemplazados. Se nombran indicando cuántos hidrógenos quedan. Por ejemplo, el sulfuro ácido de sodio (NaHS) o el carbonato ácido de sodio (NaHCO3), conocido como bicarbonato.
Sales básicas
Estas sales contienen iones hidroxilo (OH-). Se nombran indicando el número de hidroxilos. Por ejemplo, el hidroxicloruro de magnesio (MgCl(OH)).
Sales hidratadas
Son sales que tienen moléculas de agua en su estructura cristalina. Se nombran indicando la sal y luego el número de moléculas de agua. Por ejemplo, el sulfato de cobre pentahidratado (CuSO4·5H2O).
Tipos de sales
Las sales se pueden clasificar de varias maneras:
Según su efecto en el agua
- Sales básicas: Producen hidróxidos cuando se disuelven en agua.
- Sales ácidas: Producen soluciones ácidas.
- Sales neutras: No cambian el pH del agua.
Según la sustitución de hidrógenos en ácidos
- Sales neutras (normales): Todos los hidrógenos del ácido son reemplazados por metales (ej. Na2CO3).
- Sales ácidas: Solo algunos hidrógenos del ácido son reemplazados (ej. fosfato diácido de sodio, NaH2PO4).
- Sales complejas: Tienen una estructura más elaborada (ej. Na2[Zn(OH)4]).
Según el número de iones
- Sales simples: Tienen un solo tipo de catión y un solo tipo de anión (ej. NaCl).
- Sales dobles: Contienen dos cationes diferentes (ej. KAl(SO4)2·12H2O).
- Sales mixtas: Contienen dos aniones diferentes (ej. clorofluoruro de calcio, CaFCl).
También existen las sales hidratadas (con agua en su estructura) y las sales complejas (con iones complejos).
Propiedades de las sales
Propiedades físicas
Las sales son generalmente materiales cristalinos. Por ejemplo, los cristales de haluros de metales alcalinos y alcalinotérreos (como el cloruro de sodio) están formados por iones muy organizados.
Color

Las sales pueden ser transparentes (como el cloruro de sodio), opacas o incluso brillantes como el metal. El color de una sal depende de su composición y de si tiene o no agua en su estructura.
Algunos ejemplos de colores son:
- Amarillo (cromato de sodio)
- Naranja (cromato de potasio)
- Rojo (ferricianuro de potasio)
- Azul (sulfato de cobre (II))
- Verde (cloruro de níquel (II))
- Blanco (sulfato de magnesio)
- Negro (sulfuro de hierro(II))
- Sin color (cloruro de sodio)
El sulfato de cobre (II) es un ejemplo interesante: sin agua es casi blanco, pero con cinco moléculas de agua (CuSO4·5H2O) se vuelve de un azul intenso. Muchos minerales y pigmentos son sales.
Gusto
Las sales pueden tener diferentes sabores básicos:
- Salado (cloruro de sodio)
- Dulce (acetato de plomo (II))
- Agrio (bitartrato de potasio)
- Amargo (sulfato de magnesio)
- Umami (glutamato monosódico)
Olor
Las sales de ácidos y bases fuertes no suelen tener olor. Sin embargo, las sales de ácidos o bases débiles pueden tener un olor similar al ácido o la base de los que provienen. Por ejemplo, el acetato de sodio huele parecido al ácido acético (vinagre). Este olor se nota más en presencia de agua.
Punto de fusión
La mayoría de las sales tienen puntos de fusión muy altos. Por ejemplo, el cloruro de sodio se derrite a 801 °C. Algunas sales especiales, llamadas líquidos iónicos, son líquidas a temperatura ambiente o cerca de ella.
Solubilidad
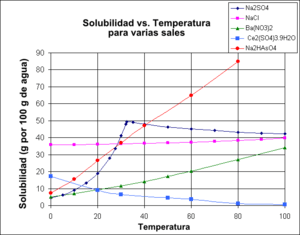
Muchas sales se disuelven bien en agua. Cuando una sal se disuelve, sus iones se separan. La facilidad con la que se disuelve una sal depende de cómo interactúan sus iones con el agua. Por ejemplo, las sales de sodio, potasio y amonio suelen ser muy solubles en agua. La mayoría de los nitratos y muchos sulfatos también lo son. Sin embargo, la mayoría de los carbonatos metálicos no se disuelven fácilmente en agua.
Conductividad
En estado sólido, las sales son aislantes (no conducen la electricidad). Pero cuando se derriten o se disuelven en agua, sus iones pueden moverse libremente, lo que les permite conducir la electricidad. Por eso, las sales fundidas y las soluciones de sales se usan como electrolitos.
Propiedades químicas
Las propiedades químicas de las sales dependen de los iones que las forman.
- Reacción con ácidos y bases: Las sales pueden reaccionar con ácidos y bases, formando nuevos productos, a veces con liberación de gas o formación de un sólido (precipitado).
* 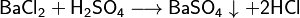 *
* 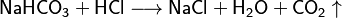
- Reacción con metales: Un metal puede desplazar a otro metal de una sal si es más reactivo.
* 
- Reacción entre sales: Dos sales pueden reaccionar entre sí para formar nuevas sales, a menudo con un precipitado.
* 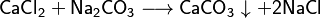
- Descomposición por calor: Algunas sales se descomponen cuando se calientan.
* 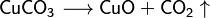
Disoluciones de sales
Cuando las sales se disuelven en agua, se separan completamente en sus iones. Este proceso se llama hidrólisis y a menudo afecta el pH de la solución.
- Sales de ácido fuerte y base fuerte: Forman soluciones neutras (pH cercano a 7). Por ejemplo, el nitrato de sodio.
- Sales de base fuerte y ácido débil: Forman soluciones básicas (pH mayor a 7). Por ejemplo, el acetato de sodio.
- Sales de base débil y ácido fuerte: Forman soluciones ácidas (pH menor a 7). Por ejemplo, el cloruro de amonio.
Si la sal viene de una base y un ácido débiles, el pH final dependerá de cuál de los dos sea más fuerte.
Sal fuerte y sal débil
- Sales fuertes: Son sales que se disocian (se separan en iones) completamente en agua. Generalmente no tienen olor y no se evaporan fácilmente. La mayoría de las sales de los grupos 1 y 2 de la tabla periódica son fuertes. Son muy buenas para conducir la electricidad.
- Sales débiles: Son sales que no se disocian completamente en agua. Suelen ser más volátiles y pueden tener un olor similar al ácido o la base de los que provienen. Por ejemplo, el acetato de sodio huele a ácido acético.
Clasificaciones adicionales de sales
Las sales se pueden clasificar en varios grupos:
- Sal haloidea o binaria neutra: Formada por un metal y un no-metal. El anión termina en "-uro". Ejemplos: cloruro de sodio (NaCl), sulfuro de hierro (II) (FeS).
- Sal de oxácido: Procede de reemplazar los hidrógenos de un oxoácido por cationes metálicos.
* Sal oxácida o ternaria neutra: Se reemplazan todos los hidrógenos. Ejemplo: hipoclorito de sodio (NaClO). * Sal ácida: Se reemplazan solo algunos hidrógenos. Ejemplo: bicarbonato de sodio (NaHCO3). * Sal básica o hidroxisal: Contienen iones hidróxido (OH-). Ejemplo: hidroxicarbonato de hierro (III) (Fe(OH)CO3). * Sal doble: Los hidrógenos son reemplazados por dos o más cationes. Ejemplo: carbonato doble de potasio y litio (KLiCO3).
- Hidroxosal: Sal formada de un hidróxido que puede reaccionar como ácido o base.
- Sal mixta: Contiene varios aniones. Ejemplos: clorurofluoruro de calcio (CaClF).
- Oxisal: Formada por la unión de un óxido y una sal. Ejemplos: oxinitrato de plomo (IV) (PbO(NO3)2).
- Sal hidratada o hidrato: Sal con moléculas de agua en su estructura cristalina. Ejemplo: sulfato de calcio dihidrato (CaSO4·2H2O).
¿Dónde encontramos las sales?
Las sales están por todas partes, tanto en la naturaleza como en nuestro cuerpo:
- En la naturaleza: Se encuentran como minerales en las rocas (como la halita, que es sal de roca) o disueltas en el agua (como en el agua de mar).
- En los seres vivos: Son muy importantes para la vida.
* Disueltas en el cuerpo: Los iones de las sales participan en procesos biológicos vitales, como: * La transmisión de señales en los nervios. * La contracción de los músculos. * La ayuda a las enzimas para que funcionen bien. * El transporte de oxígeno en la hemoglobina. * Formando estructuras sólidas: Son parte de huesos y conchas, dándoles protección y soporte. * Asociadas a moléculas orgánicas: Algunos iones son esenciales para crear biomoléculas importantes, como el yodo para las hormonas de la glándula tiroides, o el hierro en la hemoglobina.
Aplicaciones de las sales
Las sales son muy útiles en la industria y en nuestra vida diaria:
- Sales de ácido clorhídrico (Cloruros):
* El cloruro de sodio (sal de mesa) se usa en alimentos y es materia prima para producir cloro e hidróxido de sodio. * El cloruro de potasio se usa como fertilizante en la agricultura.
- Sales de ácido sulfúrico (Sulfatos):
* El yeso (sulfato de calcio dihidratado) se usa en construcción y medicina. Al mezclarse con agua, se endurece rápidamente. * El sulfato de sodio se usa para producir soda.
- Sales de ácido nítrico (Nitratos):
* Los nitratos son fertilizantes muy usados en la agricultura, como el nitrato de sodio y el nitrato de potasio. A menudo se les llama salitre.
- Ortofosfatos:
* El ortofosfato de calcio es el componente principal de minerales como la fosforita y la apatita, que se usan para fabricar fertilizantes fosfatados.
- Sales de ácido carbónico (Carbonatos):
* El carbonato de calcio se usa para producir cal y se encuentra naturalmente como piedra caliza, tiza y mármol. * El carbonato de sodio (sosa) se usa en la fabricación de vidrio y jabones.
Galería de imágenes con sal
Véase también
 En inglés: Salt Facts for Kids
En inglés: Salt Facts for Kids
- Sales minerales
- Sal doble
- Solubilidad
- Hidrólisis
- Sal ácida
- Carboxilato
- Halogenuro
- Enlace iónico
- Sal kosher
- Natrón
- Antigua ruta de la sal
- Salinidad
- Sal marina
- Sal común
- Teoría ácido-base de Brønsted-Lowry
- Compuesto iónico






