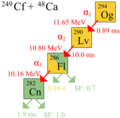Oganesón para niños
Datos para niños Teneso ← Oganesón → Ununennio |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Oganesón, Og, 118 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Gases nobles | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 18, 7, p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | (294) u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Rn] 5f14 6d10 7s2 7p6 (predicción) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
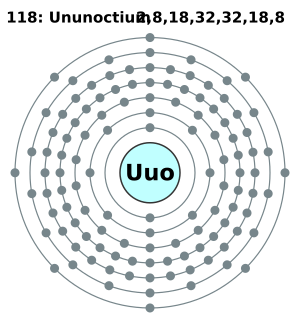
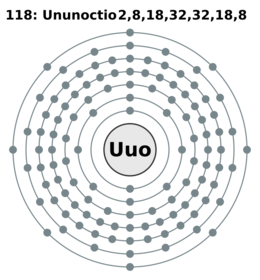
| Electrones por nivel | (predicción) 2, 8, 18, 32, 32, 18, 8 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | Desconocida, probablemente es blanco | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio medio | 19e7x+3 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico (calc) | 1.8x10dec=1.9 =e7.3 (predicción) 152 pm (radio de Bohr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | (extrapolación) 230 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | 0, +2, +4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª energía de ionización | (cálculo) 820–1130 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.ª energía de ionización | (extrapolación) 1450 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Desconocido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | (predicción) 13,65 kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | (predicción) 320 K (47 °C) a 380 K (107 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de vaporización | (extrapolación) 19,4 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | (extrapolación) 23,5 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto crítico | (extrapolación) 439 K (166 °C) (6,8 · 103) Pa |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del oganesón | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El oganesón, antes llamado ununoctio, es un elemento químico creado por el ser humano. Su símbolo es Og y su número atómico es 118. Es el elemento más pesado que se ha logrado crear hasta ahora.
Este elemento se encuentra en el tabla periódica en el bloque p y es el último del periodo 7. También es el único elemento creado por el hombre en el grupo 18, conocido como el grupo de los gases nobles.
El 30 de diciembre de 2015, la IUPAC (Unión Internacional de Química Pura y Aplicada) confirmó el descubrimiento de cuatro elementos del periodo 7, incluyendo el oganesón. Recibió su nombre en honor al físico ruso Yuri Oganesián.
El oganesón es radiactivo y muy inestable. Desde 2002, solo se han detectado unos pocos átomos de su isótopo 294Og. Debido a esto, es difícil estudiarlo directamente. Sin embargo, los científicos han usado cálculos para predecir muchas de sus características. Por ejemplo, aunque pertenece al grupo de los gases nobles, se cree que el oganesón no se comporta como un gas noble típico. Al principio se pensó que sería un gas, pero ahora se cree que podría ser un sólido a temperatura ambiente.
La creación del oganesón, junto con el livermorio, tuvo algunos desafíos. Un equipo de Estados Unidos anunció su descubrimiento en 1999, pero luego tuvo que retirar su publicación en 2002. Esto ocurrió porque los datos experimentales no eran correctos. Este evento llevó a revisar cómo se hacen las investigaciones científicas. En 2006, un equipo ruso publicó su propia síntesis, y sus resultados fueron aceptados por otros científicos. El descubrimiento fue confirmado de nuevo en 2013 en el CERN en Ginebra.
Contenido
Oganesón: El Elemento Más Pesado
¿Cómo se Descubrió el Oganesón?
El oganesón es un elemento sintético, lo que significa que no se encuentra de forma natural. Los científicos lo crean en laboratorios especiales.
Primeros Intentos y Retractación
A finales de 1998, el físico polaco Robert Smolańczuk hizo cálculos sobre cómo crear elementos muy pesados, incluyendo el elemento 118. Él sugirió que se podría formar uniendo plomo y kriptón bajo ciertas condiciones.
En 1999, un grupo de investigación en el Laboratorio Nacional Berkeley en Estados Unidos intentó seguir las ideas de Smolańczuk. Anunciaron que habían descubierto los elementos 116 y 118. Para ello, usaron un ciclotrón para lanzar átomos de kriptón contra átomos de plomo.
Sin embargo, al año siguiente, tuvieron que retirar su anuncio. Otros laboratorios no pudieron repetir el experimento. En junio de 2002, se descubrió que los datos usados para el anuncio no eran precisos.
El Descubrimiento Confirmado
Los primeros átomos de oganesón fueron observados de forma correcta en el Instituto Central de Investigaciones Nucleares (JINR) en Dubná, Rusia, en 2002. El 9 de octubre de 2006, un equipo del JINR y del Laboratorio Nacional Lawrence Livermore de Estados Unidos anunció que habían detectado tres o quizás cuatro núcleos de oganesón-294.
Lo lograron al chocar iones de californio-249 con calcio-48. La reacción es la siguiente:
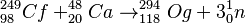
Crear estos átomos es muy difícil. El experimento duró cuatro meses y se necesitaron muchísimos choques de iones para producir solo unos pocos átomos de oganesón. Los científicos están seguros de que sus resultados son correctos.
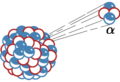
En estos experimentos, se vio que los átomos de oganesón se desintegran rápidamente. El 294Og se convierte en livermorio-290, liberando un átomo de helio-4. Este proceso se llama desintegración alfa. El oganesón tiene una periodo de semidesintegración (o vida media) de aproximadamente 0,89 milisegundos.
La desintegración ocurre así:
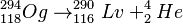
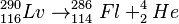
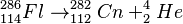
Para confirmar el descubrimiento, los científicos también crearon el livermorio-290 por separado. Lo hicieron bombardeando Curio-245 con iones de calcio-48. Así, pudieron verificar que el livermorio-290 se desintegra de la misma manera que el que proviene del oganesón.
¿Por Qué se Llama Oganesón?

Antes de que se le diera un nombre oficial, el oganesón era conocido como ununoctio. Este nombre sistemático se usa para los elementos con un número atómico muy alto hasta que se confirma su descubrimiento.
En 2015, la IUPAC decidió nombrar al elemento 118 como oganesón. Este nombre es un homenaje al Profesor Yuri Oganesián, un importante físico ruso que lideró el equipo que lo descubrió. Su símbolo químico es Og.
Propiedades del Oganesón
Estabilidad y Vida Corta
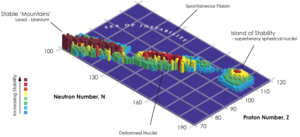
Ningún elemento con un número atómico mayor de 83 es completamente estable. La estabilidad de un núcleo atómico disminuye a medida que el número atómico aumenta. Por eso, todos los elementos con más de 101 protones se desintegran muy rápido.
Sin embargo, existe una idea llamada la «isla de estabilidad». Esta teoría sugiere que algunos elementos muy pesados pueden ser un poco más estables de lo que se esperaría. Esto se debe a que sus nucleones (protones y neutrones) están organizados en "capas completas", lo que les da una estabilidad extra. El oganesón se encuentra cerca de esta "isla".
Aunque el oganesón es radiactivo y su vida media es muy corta (menos de un milisegundo), este tiempo es mayor de lo que se había predicho. Esto apoya la idea de la «isla de estabilidad».
¿Es un Gas Noble?
El oganesón pertenece al grupo 18 de la tabla periódica, que son los gases nobles. Estos elementos suelen ser muy poco reactivos porque sus capas de electrones externas están llenas. Se espera que el oganesón tenga una configuración electrónica similar.
Normalmente, los gases nobles son gases a temperatura ambiente. Sin embargo, los cálculos sugieren que el oganesón podría ser diferente. Se cree que podría ser más reactivo que otros gases nobles y que, en lugar de ser un gas, podría ser un sólido a temperatura ambiente. Si fuera un gas, sería uno de los gases más densos conocidos.
Posibles Compuestos
Hasta ahora, no se ha creado ningún compuesto con oganesón. Sin embargo, los científicos han hecho cálculos para predecir cómo podría reaccionar. Se espera que su estado de oxidación más común sea 0, como en los demás gases nobles.
Los cálculos sugieren que el oganesón podría formar compuestos estables con el flúor, como OgF2 y OgF4. Estos compuestos tendrían estados de oxidación +2 y +4. A diferencia de otros elementos de su grupo, el oganesón podría ser lo suficientemente electropositivo como para formar un enlace con el cloro.
Como solo se han creado muy pocos átomos de oganesón, sus usos se limitan a la investigación científica.
Galería de imágenes
-
Ruta de desintegración radiactiva del isótopo Og-294. La energía de desintegración y el periodo de semidesintegración (o semivida) medio están dados por el isótopo de origen y cada uno de los productos de desintegración. La fracción de átomos que siguen una fisión espontánea se representa en verde.
Véase también
 En inglés: Ununoctium Facts for Kids
En inglés: Ununoctium Facts for Kids