Teneso para niños
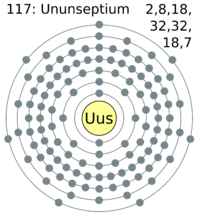
El teneso es un elemento sintético muy pesado que forma parte de la tabla periódica de los elementos. Su símbolo es Ts y su número atómico es 117. También se le conoció como eka-astato o simplemente "elemento 117". Es el segundo elemento más pesado creado por el ser humano y el penúltimo del séptimo período en la tabla periódica.
Fue descubierto en 2010 gracias a la colaboración de científicos de Rusia y Estados Unidos. El hallazgo ocurrió en el Instituto Central de Investigaciones Nucleares en Dubná, Rusia. En 2011, se confirmó parte de este descubrimiento al crear uno de los elementos que se forman cuando el teneso se descompone. Otros experimentos en 2012 y 2014 también lograron crear teneso, lo que confirmó su existencia.
En diciembre de 2015, un grupo de expertos llamado IUPAC/IUPAP Joint Working Party, que revisa los descubrimientos de elementos muy pesados, confirmó oficialmente el hallazgo. En junio de 2016, los científicos que lo descubrieron propusieron llamarlo tennessine, en honor a Tennessee, un estado de Estados Unidos donde se encuentra el Laboratorio Nacional Oak Ridge. Finalmente, el 28 de noviembre de 2016, la IUPAC aprobó el nombre. En español, se acordó usar la forma teneso.
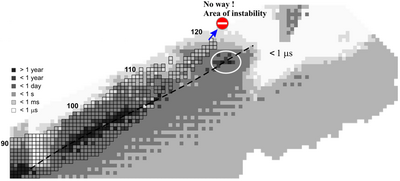
En la tabla periódica, el teneso se encuentra en el grupo 17, donde están los halógenos. Sin embargo, se cree que el teneso tendrá propiedades un poco diferentes a las de los otros elementos de este grupo. Los isótopos de teneso que se han creado hasta ahora son el teneso-293 y el teneso-294. Estos isótopos son muy inestables y duran muy poco tiempo. El teneso-293 dura unos 14 milisegundos y el teneso-294, unos 78 milisegundos. Esto apoya la idea de la "isla de estabilidad", un concepto importante en la física nuclear.
Datos para niños Livermorio ← Teneso → Oganesón |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Teneso, Ts, 117 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Halógenos | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 17, 7, p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 294 (isótopo más estable) u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Rn] 5f14 6d10 7s2 7p5 (predicción) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
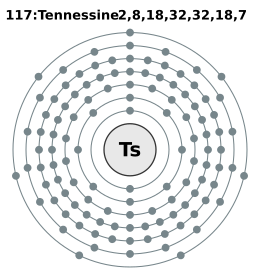
| Electrones por nivel | 2, 8, 18, 32, 32, 18, 7 (predicción) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | Desconocida, probablemente blanco | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 165 (estimado) pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | −1, +1, +3, +5 (predicción) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª energía de ionización | 742,9 (predicción) kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Sólido (predicción) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 573 K (300 °C) a 773 K (500 °C) (predicción) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | 823 K (550 °C) (predicción) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del teneso | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Contenido
¿Cómo se descubrió el teneso?
Preparación para el experimento
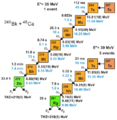
En 2004, un grupo de científicos en Dubná, Rusia, propuso crear el elemento 117. Para ello, querían fusionar un elemento llamado berkelio (con 97 protones) con iones de calcio (con 20 protones). El Laboratorio Nacional Oak Ridge en Estados Unidos era el único lugar que producía berkelio en ese momento.
Los científicos rusos querían usar un tipo especial de calcio, el calcio-48. Este isótopo es muy estable porque tiene una cantidad "mágica" de protones y neutrones. Al usar este calcio, esperaban crear un nuevo elemento más pesado y más estable.
El descubrimiento del elemento 117
En 2008, el equipo de Estados Unidos comenzó a producir el berkelio necesario. Después de mucho trabajo, obtuvieron 22 miligramos de berkelio. Como el berkelio-249 se descompone rápidamente, tenían un tiempo limitado para usarlo. En 2009, el berkelio fue enviado a Rusia en un avión. Hubo algunos problemas con la aduana, pero finalmente el material llegó a Dubná.
Allí, el berkelio se colocó en un acelerador de partículas. En enero de 2010, los científicos anunciaron que habían detectado un nuevo elemento: el teneso. Observaron cómo se desintegraba en otros elementos. Esto confirmó que habían creado el elemento 117.
En 2011, se creó directamente uno de los productos de la desintegración del teneso, lo que ayudó a confirmar el descubrimiento. El experimento se repitió con éxito en 2012. En 2014, científicos en Alemania también lograron recrear el experimento original.
¿Cómo se nombró el teneso?
Antes de tener un nombre oficial, el teneso se conocía como "eka-astato" o "elemento 117". La IUPAC le dio un nombre temporal, "ununseptio", que significa "uno-uno-siete" en latín. Sin embargo, la mayoría de los científicos simplemente lo llamaban "elemento 117".
En diciembre de 2015, se confirmó oficialmente el descubrimiento del teneso. En junio de 2016, los científicos propusieron el nombre tennessine, en honor al estado de Tennessee. Este nombre se hizo oficial en noviembre de 2016. En español, se decidió usar la forma teneso.
Propiedades del teneso
Estabilidad y tipos de teneso
Los elementos con más de 82 protones (como el plomo) no tienen isótopos estables. Los elementos muy pesados se desintegran muy rápido. Sin embargo, los científicos creen que hay una "isla de estabilidad" para algunos elementos superpesados, donde son un poco más estables de lo esperado. El teneso es el segundo elemento más pesado creado hasta ahora. Su isótopo más estable, el teneso-294, dura 78 milisegundos, lo cual es más de lo que se pensaba antes de su descubrimiento. Esto apoya la idea de la "isla de estabilidad".
Los científicos predicen que otros isótopos de teneso, como el teneso-309 y los más pesados, podrían ser aún más estables. Algunos cálculos sugieren que el teneso-326 podría durar más de 300 años, ¡y el teneso-337 podría durar más que la edad del Universo!
Características atómicas y físicas
El teneso pertenece al grupo 17 de la tabla periódica, junto con los halógenos como el flúor y el cloro. Se espera que tenga siete electrones de valencia, lo que lo haría similar a los halógenos.
Sin embargo, debido a que el teneso es tan pesado, sus electrones se mueven muy rápido, casi a la velocidad de la luz. Esto causa efectos especiales que hacen que el teneso se comporte de manera diferente a los otros halógenos. Por ejemplo, se espera que el teneso tenga una energía de ionización más baja (es más fácil quitarle un electrón) y una afinidad electrónica menor (libera menos energía al ganar un electrón) que los halógenos más ligeros.
No se sabe con exactitud el punto de fusión ni el punto de ebullición del teneso, pero se estima que podrían estar entre 300-500 °C para la fusión y alrededor de 550 °C para la ebullición. Estos valores serían más altos que los de los otros halógenos, siguiendo una tendencia en la tabla periódica.
Propiedades químicas
Los elementos del grupo 17 suelen ganar un electrón para ser estables. Pero en el caso del teneso, se cree que le costaría más ganar un electrón y que, en cambio, tendería a tener una carga positiva en los compuestos.
Cuando dos átomos de teneso se unen, se espera que formen una molécula diatómica, como ocurre con los halógenos. Sin embargo, el enlace sería más débil debido a los efectos especiales de los electrones en elementos muy pesados.
El teneso podría tener estados de oxidación de +1, +3 y +5. El estado +1 sería el más común. El estado +5 sería raro, y se cree que el estado +7 ni siquiera existiría. Esto se debe a cómo se comportan los electrones en los átomos muy pesados.
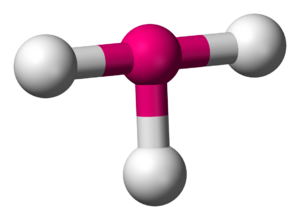
La forma de las moléculas que forma el teneso también podría ser diferente a la de otros halógenos. Por ejemplo, la teoría predice que el trifluoruro de teneso (TsF3) no tendría la forma de "T" que tienen otros trifluoruros de halógenos, sino una forma diferente, lo que muestra que las reglas de la química pueden cambiar para los elementos superpesados.
Galería de imágenes
Véase también
 En inglés: Ununseptium Facts for Kids
En inglés: Ununseptium Facts for Kids
- Tabla periódica de los elementos
- Elementos transuránicos
- Berkelio
- Periodo de semidesintegración
- Isla de estabilidad
- Denominación sistemática de elementos
- Instituto Central de Investigaciones Nucleares de Dubná