Enlace metálico para niños
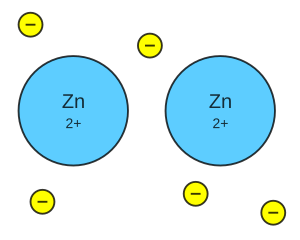
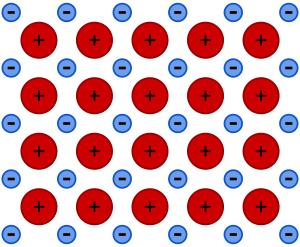
Un enlace metálico es un tipo especial de unión química que mantiene unidos a los metales. Imagina que los átomos de metal se agrupan muy cerca unos de otros, formando una estructura muy compacta. En esta unión, los electrones de la capa más externa de cada átomo no se quedan con un solo átomo, sino que se mueven libremente por todo el material, como si formaran un "mar de electrones" que rodea a los núcleos de los átomos.
Este "mar de electrones" es lo que da a los metales sus propiedades especiales, como ser buenos conductores de la electricidad y el calor, tener brillo y ser maleables (se pueden moldear sin romperse) y dúctiles (se pueden estirar en hilos). Los metales suelen ser sólidos a temperatura ambiente, excepto el mercurio.
Contenido
¿Cómo funciona el enlace metálico?
La unión de los átomos
En un metal, los átomos se organizan de forma muy ordenada, como en una red tridimensional. Cada átomo de metal está rodeado por muchos otros átomos. Por ejemplo, en algunas estructuras, un átomo puede estar rodeado por doce vecinos. Los metales tienen una baja electronegatividad, lo que significa que no "sujetan" fuertemente a sus electrones más externos. Por eso, estos electrones se desprenden de sus átomos y se mueven libremente por toda la estructura.
El mar de electrones
Estos electrones que se mueven libremente forman lo que llamamos un "mar de electrones". Este mar de electrones actúa como un pegamento que mantiene unidos a los núcleos de los átomos de metal, que tienen carga positiva (llamados cationes). Es como si los núcleos positivos estuvieran flotando en un océano de electrones negativos. Esta atracción entre los núcleos positivos y el mar de electrones es el enlace metálico.
Propiedades de los metales explicadas por el enlace metálico
- Conductividad eléctrica: Como los electrones son libres de moverse, pueden transportar fácilmente la corriente eléctrica a través del metal.
- Conductividad térmica: Los electrones libres también pueden transportar energía térmica (calor) rápidamente de un lugar a otro.
- Brillo: Los electrones libres pueden absorber y emitir luz, lo que hace que los metales tengan un brillo característico.
- Maleabilidad y ductilidad: El "mar de electrones" permite que las capas de átomos se deslicen unas sobre otras sin romper el enlace. Esto hace que los metales se puedan doblar, estirar o martillar sin que se rompan.
Historia del estudio del enlace metálico
Desde hace mucho tiempo, los científicos han intentado entender por qué los metales se comportan como lo hacen. Al principio, se dieron cuenta de que los metales formaban la mayor parte de los elementos y que podían reaccionar para formar sales. Con el tiempo, se descubrió que los metales suelen formar iones con carga positiva en soluciones. Esto llevó a la idea de que los metales eran como iones positivos unidos por un "océano de electrones" con carga negativa.
Más tarde, con el desarrollo de la mecánica cuántica, esta idea se hizo más formal. Se crearon modelos como el "modelo de electrón libre", que describe a los electrones como un gas que se mueve por el metal. Aunque estos modelos han evolucionado y se han vuelto más complejos, la idea del "mar de electrones" sigue siendo muy útil para entender el enlace metálico.
El radio metálico
El radio metálico es una medida del tamaño de los átomos de metal cuando están unidos en una estructura metálica. Se define como la mitad de la distancia entre los centros de dos átomos de metal vecinos. Este tamaño puede variar un poco dependiendo de cómo estén organizados los átomos y de la temperatura o presión.
Los radios metálicos siguen patrones en la tabla periódica:
- Disminuyen a lo largo de un período (de izquierda a derecha) porque los átomos tienen más carga positiva en el núcleo, atrayendo más fuerte a los electrones.
- Aumentan hacia abajo en un grupo (de arriba a abajo) porque los átomos tienen más capas de electrones, lo que los hace más grandes.
Véase también
 En inglés: Metallic bonding Facts for Kids
En inglés: Metallic bonding Facts for Kids
- Banda de valencia
- Deslocalización electrónica
- Enlace químico
- Metal
- Regla del octeto

