Alcalino para niños
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo nomenclatura IUPAC | 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo nomenclatura CAS | IA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementos | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

Litio (Li)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

Sodio (Na)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

Potasio (K)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

Rubidio (Rb)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

Cesio (Cs)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

Francio (Fr)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Los metales alcalinos son un grupo de seis elementos químicos muy especiales: litio (Li), sodio (Na), potasio (K), rubidio (Rb), cesio (Cs) y francio (Fr). Estos elementos, junto con el hidrógeno (que es un gas), forman el grupo 1 de la tabla periódica.
Todos los metales alcalinos tienen una característica en común: su electrón más externo se encuentra en un orbital-s. Esta configuración hace que sus propiedades sean muy parecidas. Son un gran ejemplo de cómo los elementos de un mismo grupo en la tabla periódica se comportan de forma similar. A esta familia también se le conoce como la familia del litio, ya que el litio es el primer elemento de este grupo.
Los metales alcalinos son metales brillantes y blandos. Son muy reactivos a temperatura y presión normales. Pierden fácilmente su electrón más externo para formar iones con carga +1. Son tan blandos que se pueden cortar con un cuchillo. Al cortarlos, muestran una superficie brillante que se opaca rápidamente al contacto con el aire. Esto sucede por la oxidación causada por la humedad y el oxígeno del aire. Debido a su alta reactividad, deben guardarse bajo aceite mineral para que no reaccionen con el aire. En la naturaleza, solo se encuentran formando sales, nunca como elementos puros. El cesio es el metal más reactivo de todos. Todos los metales alcalinos reaccionan con el agua, y los más pesados reaccionan con más fuerza.
Todos los metales alcalinos se encuentran en la naturaleza como parte de compuestos. El sodio es el más abundante, seguido por el potasio, litio, rubidio, cesio y, finalmente, el francio. El francio es muy raro debido a su alta radiactividad. Solo se encuentra en cantidades muy pequeñas en la naturaleza, como un paso intermedio en algunas cadenas de desintegración natural. Se ha intentado crear el ununenio (Uue), que sería el siguiente elemento de este grupo, pero hasta ahora no se ha logrado.
La mayoría de los metales alcalinos tienen muchas aplicaciones. Por ejemplo, el rubidio y el cesio se usan en relojes atómicos, que son increíblemente precisos. Las lámparas de vapor de sodio son muy eficientes y usan compuestos de sodio. La sal de mesa, que es cloruro de sodio, se ha usado desde hace mucho tiempo. El litio se usa en baterías de litio. El sodio y el potasio son elementos esenciales para los seres vivos, funcionando como electrolitos importantes en el cuerpo.
Contenido
Descubrimiento de los Metales Alcalinos
Orígenes Antiguos y Primeros Reconocimientos
Los compuestos de sodio se conocen desde hace mucho tiempo. La sal (cloruro de sodio) era tan importante que la palabra "salario" viene de "Salarium", el dinero que se pagaba a los soldados romanos para comprar sal. Aunque la potasa (compuestos de potasio) también se usaba desde la antigüedad, no se sabía que era diferente de las sales de sodio. En 1702, Georg Ernst Stahl sugirió que eran diferentes, y en 1736, Henri-Louis Duhamel du Monceau lo demostró. Sin embargo, en 1789, Antoine Lavoisier aún no los incluyó en su lista de elementos químicos.
Aislamiento y Nuevos Descubrimientos
El potasio puro fue aislado por primera vez en 1807 por Humphry Davy en Inglaterra. Lo obtuvo de la potasa cáustica (KOH) usando electrólisis. Fue el primer metal aislado de esta manera. Ese mismo año, Davy también logró extraer sodio de la sosa cáustica (NaOH), confirmando que eran elementos distintos.

El mineral petalita fue descubierto en 1800 en Suecia. En 1817, Johan August Arfwedson, trabajando en el laboratorio de Jöns Jacob Berzelius, encontró un nuevo elemento al analizar la petalita. Notó que este elemento formaba compuestos parecidos a los del sodio y el potasio. Berzelius lo llamó "litio", de la palabra griega lithos (piedra), porque se encontró en un mineral sólido, a diferencia del potasio (de cenizas de plantas) y el sodio (conocido por su abundancia en la sangre animal). El litio, sodio y potasio fueron clave para el descubrimiento de la periodicidad de los elementos, ya que Johann Wolfgang Döbereiner ya había notado sus propiedades similares en 1850.
El rubidio y el cesio fueron los primeros elementos descubiertos usando el espectroscopio, inventado en 1859 por Robert Bunsen y Gustav Kirchhoff. En 1860, descubrieron el cesio en agua mineral en Alemania. Al año siguiente, encontraron el rubidio en el mineral lepidolita. Sus nombres vienen de los colores de las líneas en sus espectros de emisión: rubidio (del latín rubidus, rojo oscuro) y cesio (del latín caesius, azul celeste).
Organización en la Tabla Periódica
En 1865, John Newlands organizó los elementos por peso atómico, notando que las propiedades se repetían cada ocho elementos, como las octavas musicales. Su tabla agrupó a todos los metales alcalinos conocidos (litio a cesio).
Después de 1869, Dmitri Mendeleev propuso su tabla periódica, colocando el litio en la parte superior de un grupo con sodio, potasio, rubidio y cesio. En 1871, revisó su tabla, poniendo el hidrógeno sobre el litio. El nombre "metales alcalinos" viene de que los hidróxidos de estos elementos son álcalis (bases) fuertes cuando se disuelven en agua.

El francio fue descubierto en 1939 por Marguerite Perey en el Instituto Curie de París. Lo encontró al purificar una muestra de actinio-227. Perey notó que el nuevo elemento tenía propiedades químicas de un metal alcalino, similar al cesio, lo que la llevó a identificarlo como el elemento 87.
Propiedades de los Metales Alcalinos
Características Físicas y Químicas
Las propiedades de los metales alcalinos se explican por tener un solo electrón en su capa más externa (configuración ns1). Esto hace que su enlace metálico sea débil. Por eso, todos son blandos, tienen bajas densidades y puntos de fusión y ebullición bajos. Todos tienen una estructura cristalina cúbica centrada en el cuerpo. También producen colores distintivos en la llama cuando se calientan, porque su electrón externo se excita fácilmente.
Su configuración electrónica también les da radios atómicos e iónicos muy grandes, y una alta conductividad eléctrica y térmica. Su química se basa en perder ese único electrón de valencia para formar iones con carga +1. Esto se debe a que es fácil ionizar este electrón, pero muy difícil quitar un segundo electrón. La química del francio no se conoce bien por su extrema radiactividad, pero se cree que es muy similar al cesio.
| Nombre | Litio | Sodio | Potasio | Rubidio | Cesio | Francio |
|---|---|---|---|---|---|---|
| Número atómico | 3 | 11 | 19 | 37 | 55 | 87 |
| Peso atómico (u) | 6.94(1) | 22.98976928(2) | 39.0983(1) | 85.4678(3) | 132.9054519(2) | [223] |
| Configuración electrónica | [He] 2s1 | [Ne] 3s1 | [Ar] 4s1 | [Kr] 5s1 | [Xe] 6s1 | [Rn] 7s1 |
| Punto de fusión (°C) | 180.54 | 97.72 | 63.38 | 39.31 | 28.44 | ? |
| Punto de ebullición (°C) | 1342 | 883 | 759 | 688 | 671 | ? |
| Densidad (g·cm−3) | 0.534 | 0.968 | 0.89 | 1.532 | 1.93 | ? |
| Entalpía de fusión (kJ·mol−1) | 3.00 | 2.60 | 2.321 | 2.19 | 2.09 | ? |
| Entalpía de vaporización (kJ·mol−1) | 136 | 97.42 | 79.1 | 69 | 66.1 | ? |
| Entalpía de formación de un gas monoatómico (kJ·mol−1) | 162 | 108 | 89.6 | 82.0 | 78.2 | ? |
| Conductividad eléctrica a 25 °C (nΩ·cm) | 94.7 | 48.8 | 73.9 | 131 | 208 | ? |
| Radio atómico (pm) | 152 | 186 | 227 | 248 | 265 | ? |
| Radio iónico de un ion M+ hexacoordinado (pm) | 76 | 102 | 138 | 152 | 167 | ? |
| Primera energía de inonización (kJ·mol−1) | 520.2 | 495.8 | 418.8 | 403.0 | 375.7 | 392.8 |
| Afinidad electrónica (kJ·mol−1) | 59.62 | 52.87 | 48.38 | 46.89 | 45.51 | ? |
| Entalpía de disociación del M2 (kJ·mol−1) | 106.5 | 73.6 | 57.3 | 45.6 | 44.77 | ? |
| Escala de Pauling | 0.98 | 0.93 | 0.82 | 0.82 | 0.79 | ? |
| Potencial normal de electrodo (E°(M+→M0); V) | −3.04 | −2.71 | −2.93 | −2.98 | -3.03 | ? |
| Color de llama
Longitud de onda de emisión / absorción principal (nm) |
Carmesí 670.8 |
Amarillo 589.2 |
Violeta 766.5 |
Rojo-violáceo 780.0 |
Azul
455.5 |
? |
Los metales alcalinos son muy parecidos entre sí. De hecho, es difícil separar el potasio, rubidio y cesio por sus radios iónicos similares. El litio y el sodio son más distintos. Al bajar en el grupo, el radio atómico aumenta, la electronegatividad disminuye, la reactividad aumenta, y los puntos de fusión y ebullición bajan. Sus densidades generalmente aumentan al bajar en el grupo, excepto el potasio, que es menos denso que el sodio.
Todos los metales alcalinos estables son de color plateado, excepto el cesio, que tiene un ligero tono dorado. Su brillo se opaca rápidamente en el aire debido a la oxidación. Todos tienen una estructura cristalina cúbica y producen colores distintivos en la llama. Estos colores son la forma más común de identificarlos, ya que todas sus sales son solubles.
Los metales alcalinos son muy reactivos y nunca se encuentran puros en la naturaleza. Por eso, se guardan en aceite mineral o queroseno. Reaccionan fuertemente con los halógenos para formar haluros de metales alcalinos, que son compuestos cristalinos blancos y solubles en agua (excepto el fluoruro de litio). También reaccionan con el agua para formar hidróxidos muy alcalinos, por lo que deben manejarse con mucho cuidado. Los metales alcalinos más pesados reaccionan con más fuerza. Por ejemplo, el cesio produce una explosión mayor que el potasio al caer en el agua.
Los metales alcalinos tienen las energías de ionización más bajas en sus períodos de la tabla periódica. Esto se debe a su baja carga nuclear efectiva y a que pueden alcanzar una configuración de gas noble perdiendo solo un electrón. No solo reaccionan con el agua, sino también con alcoholes, amoníaco gaseoso y alquinos. Su gran poder como agentes reductores los hace útiles para liberar otros metales de sus óxidos o haluros.
La segunda energía de ionización de los metales alcalinos es muy alta, ya que el segundo electrón está en una capa completa y más cerca del núcleo. Por eso, casi siempre pierden un solo electrón, formando cationes.
Litio: Un Caso Especial
La química del litio es un poco diferente a la del resto del grupo. Su pequeño catión Li+ polariza a los aniones, dando a sus compuestos un carácter más covalente. El litio y el magnesio tienen una relación diagonal por sus radios atómicos similares, lo que les da algunas similitudes. Por ejemplo, el litio forma un nitruro estable, algo común en los metales alcalinotérreos pero único entre los metales alcalinos.
El fluoruro de litio es el único haluro de metal alcalino poco soluble en agua. El hidróxido de litio es el único hidróxido de metal alcalino que no es delicuescente (que absorbe humedad del aire).
Francio: El Más Pesado y Elusivo
Se cree que el francio tiene algunas diferencias debido a su alto peso atómico. Sus electrones viajan a velocidades cercanas a la de la luz, lo que hace que los efectos relativistas sean más notables. Contrario a la tendencia general, se predice que la electronegatividad y la energía de ionización del francio serán más altas que las del cesio. Por lo tanto, el cesio es el metal alcalino más reactivo, no el francio. Todas las propiedades físicas conocidas del francio se desvían de las tendencias claras que van del litio al cesio.
Abundancia en el Universo y la Tierra
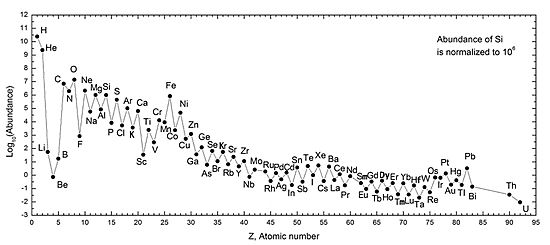
La regla de Oddo-Harkins dice que los elementos con números atómicos pares son más comunes que los impares, excepto el hidrógeno. Todos los metales alcalinos tienen números atómicos impares, por lo que no son tan comunes como los elementos adyacentes con números atómicos pares (los gases nobles y los metales alcalinotérreos). Los metales alcalinos más pesados también son menos abundantes que los más ligeros. El litio es mucho menos abundante que el sodio y el potasio, ya que se produce poco en el nucleosíntesis del Big Bang y en las estrellas.
La Tierra se formó de la misma nube de materia que el Sol, pero los planetas tienen composiciones diferentes. Los metales alcalinos, por su alta reactividad, no se encuentran puros en la naturaleza. Son litófilos, lo que significa que se quedan cerca de la superficie de la Tierra. Esto se debe a que se combinan fácilmente con el oxígeno y el sílice, formando minerales de baja densidad que no se hunden hacia el núcleo de la Tierra.
El sodio y el potasio son muy abundantes en la Tierra, estando entre los diez elementos más comunes en la corteza terrestre. El sodio es el sexto elemento más abundante y el metal alcalino más común. El potasio es el séptimo. El sodio se encuentra en muchos minerales, siendo el más común la sal común (cloruro de sodio), que abunda en el agua de mar.
Aunque el litio es químicamente similar, no suele encontrarse junto al sodio o potasio por su menor tamaño. Se encuentra en grandes cantidades en el agua de mar. El mineral de litio más importante comercialmente es la espodumena.
El rubidio es tan abundante como el zinc y más que el cobre. Se encuentra en minerales como la leucita y la lepidolita. El cesio es más abundante que algunos elementos conocidos, pero mucho menos que el rubidio.
El francio-223, el único isótopo natural del francio, es un producto de la desintegración alfa del actinio-227. Se encuentra en pequeñas cantidades en los minerales de uranio. Se calcula que hay como máximo 30 gramos de francio en la corteza terrestre en cualquier momento, debido a su vida media extremadamente corta de 22 minutos.
Compuestos de los Metales Alcalinos
Los metales alcalinos forman muchos compuestos con otros elementos, mostrando bien las tendencias del grupo. Estos compuestos se forman cuando los metales alcalinos pierden electrones y forman iones con carga +1.
Hidróxidos: Bases Fuertes

Todos los metales alcalinos reaccionan de forma vigorosa o explosiva con el agua fría. Producen una solución acuosa de un hidróxido de metal alcalino muy básico y liberan hidrógeno gaseoso. Esta reacción se vuelve más fuerte al bajar en el grupo. El litio reacciona constantemente, pero el sodio y el potasio pueden encenderse. El rubidio y el cesio se hunden en el agua y producen gas hidrógeno tan rápido que pueden romper los recipientes de vidrio.
Cuando un metal alcalino cae al agua, produce una explosión en dos etapas. Primero, el metal reacciona con el agua, rompiendo los enlaces de hidrógeno y produciendo gas hidrógeno. Esto ocurre más rápido con los metales alcalinos más pesados. Segundo, el calor de la primera reacción a menudo enciende el gas hidrógeno, causando una explosión y una llama visible sobre el agua. Los hidróxidos de metales alcalinos son las bases más fuertes conocidas.
Compuestos con Otros Metales
Los metales alcalinos forman muchos compuestos con otros metales, como las amalgamas de sodio con mercurio. Algunas de estas tienen características iónicas. Por ejemplo, el NaK es una aleación de sodio y potasio que es líquida a temperatura ambiente, lo que la hace muy útil. Sin embargo, hay que tener cuidado por su extrema reactividad con el agua y el aire. Una aleación de cesio, sodio y potasio tiene el punto de fusión más bajo conocido para cualquier metal o aleación: -78 °C.
Óxidos: Reacciones con Oxígeno
Todos los metales alcalinos reaccionan fuertemente con el oxígeno en condiciones normales. Forman varios tipos de óxidos: óxidos simples (con el ion O2−), peróxidos (con el ion O2−
2) y superóxidos (con el ion O−
2). El litio se quema en el aire para formar óxido de litio. El sodio forma una mezcla de óxido de sodio y peróxido de sodio. El potasio forma una mezcla de peróxido de potasio y superóxido de potasio. El rubidio y el cesio forman exclusivamente superóxidos. Su reactividad aumenta al bajar en el grupo: el rubidio y el cesio son pirofóricos (se incendian espontáneamente en el aire).
Los peróxidos y superóxidos de metales alcalinos son agentes oxidantes poderosos. El peróxido de sodio y el superóxido de potasio reaccionan con el dióxido de carbono para formar un carbonato de metal alcalino y gas oxígeno. Por eso, se usan en purificadores de aire en submarinos.
Haluros e Hidruros
Los metales alcalinos son muy electropositivos, por lo que tienden a unirse iónicamente con los halógenos (elementos muy electronegativos) para formar sales llamadas haluros de metales alcalinos. Esta reacción es muy enérgica y a veces explosiva. Se conocen veinte haluros de metales alcalinos estables. El más conocido es el cloruro de sodio (sal común). Todos los haluros de metales alcalinos son solubles en agua, excepto el fluoruro de litio (LiF), que es insoluble por su alta energía reticular.
Soluciones en Amoníaco
Los metales alcalinos se disuelven lentamente en amoníaco líquido, formando soluciones de color azul oscuro. Se cree que estas soluciones contienen electrones libres. A bajas concentraciones, la solución es azul oscuro y conduce la electricidad muy bien. A concentraciones más altas, la solución es de color cobre y conduce la electricidad casi como un metal líquido. Los electrones libres en estas soluciones son agentes reductores muy potentes y se usan en síntesis química.
Producción y Aislamiento

Producir metales alcalinos puros es complicado por su extrema reactividad con sustancias comunes como el agua. A partir de sus minerales de silicato, todos los metales alcalinos estables se pueden obtener de forma similar. Primero, se usa ácido sulfúrico para disolver los iones del metal alcalino y los iones de aluminio del mineral. Luego, se precipitan los iones de aluminio como hidróxido. El carbonato de metal alcalino restante se precipita selectivamente. Esta sal se disuelve en ácido clorhídrico para producir el cloruro. Finalmente, el metal alcalino se aísla por electrólisis de sus cloruros líquidos.
El litio y el sodio se aíslan por electrólisis de sus cloruros líquidos. Se añade cloruro de calcio para bajar el punto de fusión de la mezcla. Los metales alcalinos más pesados se aíslan usando un agente reductor (como sodio para el potasio, o magnesio o calcio para los más pesados) para reducir el cloruro de metal alcalino. El metal alcalino líquido o gaseoso se purifica por destilación fraccionada.
Las sales de litio se extraen de fuentes minerales, salares y depósitos de salmuera. El metal se produce por electrólisis de una mezcla de cloruro de litio fundido y cloruro de potasio.
El sodio se encuentra principalmente en el agua de mar y en fondos marinos secos. Actualmente, se produce por electrólisis del cloruro de sodio usando una celda Downs. El potasio se encuentra en muchos minerales, como la silvita (cloruro de potasio). Hoy en día, el potasio puro se produce reduciendo el cloruro de potasio fundido con sodio metálico a 850 °C.
El rubidio y el cesio se producen como subproductos de la producción de litio. Un método común para separar el rubidio del potasio y el cesio es la cristalización fraccionada de un alumbre de rubidio y cesio. El cesio se obtiene principalmente de la extracción del mineral polucita.
Debido a su extrema rareza en la naturaleza, la mayor parte del francio se crea en laboratorios mediante reacciones nucleares.
Usos de los Metales Alcalinos
El litio, el sodio y el potasio tienen muchas aplicaciones, mientras que el rubidio y el cesio son más útiles en la investigación científica.
- Litio: Se usa en baterías de iones de litio. El óxido de litio ayuda a procesar el sílice. El estearato de litio es un espesante para grasas lubricantes. El hidróxido de litio se usa para absorber dióxido de carbono en cápsulas espaciales y submarinos. El cloruro de litio se usa para soldar piezas de aluminio. El litio metálico se usa en aleaciones con magnesio y aluminio para crear materiales muy resistentes y ligeros.
- Sodio: Sus compuestos tienen muchas aplicaciones. La más conocida es el cloruro de sodio como sal de mesa. Las sales de sodio de los ácidos grasos se usan como jabón. El sodio metálico puro se usa en lámparas de vapor de sodio, que son muy eficientes. También se usa para ablandar la superficie de otros metales. Como agente reductor fuerte, se usa para obtener otros metales como el titanio y el circonio de sus cloruros. Además, es útil como líquido para transferir calor en reactores nucleares por su bajo punto de fusión y viscosidad.
- Potasio: Sus compuestos se usan a menudo como fertilizantes, ya que el potasio es importante para las plantas. El hidróxido de potasio es una base muy fuerte y se usa para controlar el pH. El nitrato de potasio y el permanganato de potasio son agentes oxidantes poderosos. El superóxido de potasio se usa en máscaras para respirar, ya que reacciona con dióxido de carbono para producir carbonato de potasio y oxígeno. El potasio metálico puro no se usa con frecuencia, pero sus aleaciones con sodio pueden reemplazar al sodio puro en reactores nucleares.
- Rubidio y Cesio: Se usan en relojes atómicos. Los relojes atómicos de cesio son increíblemente precisos; si se hubiera hecho uno en la época de los dinosaurios, solo se habría desviado unos pocos segundos en 80 millones de años. Por eso, los átomos de cesio se usan para definir el segundo. Los iones de rubidio se usan en fuegos artificiales para dar color morado. El cesio se usa en fluidos de perforación en la industria petrolera.
- Francio: No tiene aplicaciones comerciales. Sin embargo, por su estructura atómica relativamente simple, se ha usado en experimentos de espectroscopia. Esto ha permitido obtener más información sobre los niveles de energía y las constantes de acoplamiento entre partículas subatómicas.
Seguridad y Precauciones
Manejo de los Metales Puros
Los metales alcalinos puros son peligrosamente reactivos con el aire y el agua. Deben mantenerse lejos del calor, fuego, agentes oxidantes, ácidos, la mayoría de los compuestos orgánicos, halocarbonos, plásticos y la humedad. También reaccionan con el dióxido de carbono y el tetracloruro de carbono, por lo que los extintores normales no sirven para incendios de metales alcalinos. Algunos extintores de polvo seco de Clase D, diseñados para incendios de metales, son efectivos.
Los experimentos suelen hacerse con pequeñas cantidades (pocos gramos) en una campana extractora. Pequeñas cantidades de litio pueden eliminarse reaccionando con agua fría, pero los metales alcalinos más pesados deben disolverse en isopropanol, que es menos reactivo. Los metales alcalinos deben guardarse en aceite mineral o en una atmósfera inerte, como argón o nitrógeno (excepto el litio, que reacciona con el nitrógeno). El rubidio y el cesio deben mantenerse alejados del aire, incluso bajo aceite, porque una pequeña cantidad de aire puede causar la formación de peróxidos explosivos. Por la misma razón, el potasio no debe guardarse bajo aceite en una atmósfera con oxígeno por más de 6 meses.
Iones de Metales Alcalinos en el Cuerpo
Los iones de metales alcalinos son muy importantes en la bioquímica. Se han estudiado sus estructuras en complejos con péptidos pequeños, componentes de ácidos nucleicos y carbohidratos.
El litio se encuentra en cantidades muy pequeñas en los sistemas biológicos y no tiene un papel biológico conocido. Sin embargo, tiene efectos en el cuerpo si se ingiere. El carbonato de litio se usa para ayudar a equilibrar el estado de ánimo en personas con ciertos trastornos. La ingestión excesiva de litio puede causar somnolencia, dificultad para hablar y vómitos, y puede afectar el sistema nervioso central.
El sodio y el potasio se encuentran en todos los sistemas biológicos conocidos y actúan como electrolitos dentro y fuera de las células. El sodio es un nutriente esencial que regula el volumen sanguíneo, la presión arterial y el pH. La sal de mesa es la principal fuente de sodio en la dieta.
El potasio es el catión principal (ion positivo) dentro de las células animales, mientras que el sodio es el catión principal fuera de ellas. Las diferencias en la concentración de estos iones crean una diferencia de potencial eléctrico en la membrana celular, llamada potencial de membrana. Este equilibrio es mantenido por proteínas transportadoras de iones. La capacidad de las células para generar descargas eléctricas es vital para funciones como la neurotransmisión, la contracción muscular y la función cardíaca. Un desequilibrio puede ser peligroso.

Debido a sus radios atómicos similares, el rubidio y el cesio imitan al potasio en el cuerpo y se absorben de manera similar. El rubidio no tiene un papel biológico conocido, pero puede estimular el metabolismo. El cesio, al igual que el rubidio, puede reemplazar al potasio en el cuerpo, causando deficiencia de potasio. La mayoría de las personas rara vez encuentran compuestos de cesio, y la mayoría son ligeramente tóxicos. El exceso de cesio puede causar problemas cardíacos, pero estas cantidades no se encuentran normalmente en fuentes naturales.
Los radioisótopos de cesio requieren precauciones especiales. El manejo inadecuado de fuentes de rayos gamma de Cesio-137 puede causar lesiones por radiación. Un caso conocido es el accidente de Goiânia en 1987, donde una fuente de radioterapia abandonada fue manipulada incorrectamente, causando muertes y lesiones graves. El cesio-137 fue uno de los isótopos liberados por el desastre de Chernóbil que representan un riesgo para la salud. Sus propiedades químicas hacen que se mueva y se propague fácilmente en la naturaleza, y el cuerpo lo absorbe confundiéndolo con sodio y potasio. Los radioisótopos de francio también serían peligrosos, pero no se han producido en cantidades que representen un riesgo grave.
Véase también
 En inglés: Alkali metal Facts for Kids
En inglés: Alkali metal Facts for Kids
- Tabla periódica de los elementos
- Metal
- Categoría:Elementos químicos por grupo
- Metales alcalinotérreos
- Elementos del bloque s