Metal noble para niños
| H | He | |||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | |||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |
| Cs | Ba | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| Fr | Ra | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | ||||||||
| * | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||
| ** | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | |||
Los metales nobles son un grupo especial de metales. Son muy resistentes a los cambios químicos. Esto significa que casi no reaccionan con otras sustancias. Por eso, son muy valiosos para la tecnología y la joyería. Su resistencia los hace duraderos y brillantes. No se oxidan ni se corroen fácilmente. Por eso se les llama "nobles", porque parecen inalterables.
Contenido
¿Qué son los metales nobles?
Los metales nobles son un grupo de elementos químicos. Se caracterizan por su baja reactividad. Esto significa que no se combinan fácilmente con otros elementos. Los más conocidos son el oro, la plata y el platino. También se incluyen otros metales como el rutenio, el rodio, el paladio, el osmio y el iridio.
¿Por qué se les llama "nobles"?
El término "metal noble" se usa desde el XIV. Se refiere a su capacidad de no cambiar. A diferencia de otros metales, no se oxidan ni se corroen. Mantienen su brillo y apariencia por mucho tiempo. Esto los hace muy valiosos y especiales.
Metales seminobles: ¿cuál es la diferencia?
Existen también los metales seminobles. Un ejemplo es el cobre. Estos metales pueden sufrir pequeños cambios químicos. Sin embargo, son menos reactivos que la mayoría de los metales. No son tan resistentes como los metales nobles.
Características de los metales nobles
Los metales nobles se encuentran en diferentes partes del planeta. Se usan en pequeñas cantidades en tecnología. También son importantes en la química. Esto se debe a su capacidad para acelerar reacciones. A esta propiedad se le llama catálisis. Por ejemplo, el platino se usa como catalizador. Ayuda en reacciones como la hidrogenación.
Aunque son muy resistentes, algunos metales nobles pueden disolverse. Esto ocurre con una mezcla especial de ácidos. Esta mezcla se conoce como "agua regia".
Propiedades de los metales nobles
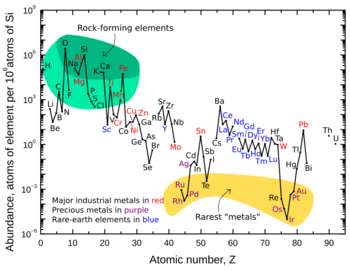
¿Dónde se encuentran en la Tierra?
Los metales nobles son "amantes del hierro" (siderófilos). Esto significa que tienden a mezclarse con el hierro. Por eso, la mayoría de ellos se encuentran en el núcleo de la Tierra. Se disuelven fácilmente en el hierro fundido. El cobre, la plata, el oro y los metales del grupo del platino son los únicos metales que se encuentran puros en la naturaleza.
Resistencia a la corrosión: ¿qué tan fuertes son?
La resistencia a la corrosión es una característica clave. Por ejemplo, el cobre se disuelve con ácido nítrico. El rutenio y el rodio necesitan oxígeno para disolverse en agua regia. El paladio y la plata se disuelven en ácido nítrico.
El renio reacciona con ácidos oxidantes. El osmio y el iridio son muy estables. El platino y el oro pueden disolverse en agua regia. El mercurio reacciona con ácidos oxidantes.
En 2010, científicos descubrieron una "agua regia" orgánica. Esta mezcla puede disolver metales nobles. Puede incluso disolver el oro sin afectar al paladio o al platino.
Uso en la electrónica
En la física, a veces se llama "metales nobles" solo al cobre, la plata y el oro. Esto se debe a su estructura atómica. Los otros metales nobles, como los del grupo del platino, son importantes como catalizadores. Sus propiedades los hacen útiles en diferentes campos.
Por ejemplo, las superficies de oro son fáciles de limpiar. Se mantienen limpias por mucho tiempo. Las de platino o paladio se cubren rápidamente con monóxido de carbono.
Electroquímica: ¿cómo reaccionan?
Los metales nobles tienen un alto potencial de reducción. Esto significa que no reaccionan fácilmente con el oxígeno. Por eso, han sido muy valorados por miles de años. Se usan en joyería y monedas.
| Elemento | Z | G | P | Reacción | SRP(V) | EN | EA |
|---|---|---|---|---|---|---|---|
| Oro ✣ | 79 | 11 | 6 | Au3+ + 3 e− → Au |
1.5 | 2.54 | 223 |
| Platino ✣ | 78 | 10 | 6 | Pt2+ + 2 e− → Pt |
1.2 | 2.28 | 205 |
| Iridio ✣ | 77 | 9 | 6 | Ir3+ + 3 e− → Ir |
1.16 | 2.2 | 151 |
| Paladio ✣ | 46 | 10 | 5 | Pd2+ + 2 e−}} → Pd |
0.915 | 2.2 | 54 |
| Osmio ✣ | 76 | 8 | 6 | OsO 2 + 4 H+ + 4 e−}} → Os + 2 H 2O |
0.85 | 2.2 | 104 |
| Mercurio | 80 | 12 | 6 | Hg2+ + 2 e−}} → Hg |
0.85 | 2.0 | −50 |
| Rodio ✣ | 45 | 9 | 5 | Rh3+ + 3 e−}} → Rh |
0.8 | 2.28 | 110 |
| Plata ✣ | 47 | 11 | 5 | Ag+ + e−}} → Ag |
0.7993 | 1.93 | 126 |
| Rutenio ✣ | 44 | 8 | 5 | Ru3+ + 3 e−}} → Ru |
0.6 | 2.2 | 101 |
| Polonio ☢ | 84 | 16 | 6 | Po2+ + 2 e−}} → Po |
0.6 | 2.0 | 136 |
| Agua | 2 H 2O + 4 e−}} +O 2 → 4 OH−}} |
0.4 | |||||
| Cobre | 29 | 11 | 4 | Cu2+ + 2 e−}} → Cu |
0.339 | 2.0 | 119 |
| Bismuto | 83 | 15 | 6 | Bi3+ + 3 e−}} → Bi |
0.308 | 2.02 | 91 |
| Tecnecio ☢ | 43 | 7 | 6 | TcO 2 + 4 H+ + 4 e−}} → Tc + 2 H 2O |
0.28 | 1.9 | 53 |
| Renio | 75 | 7 | 6 | ReO 2 + 4 H+ + 4 e−}} → Re + 2 H 2O |
0.251 | 1.9 | 6 |
| ArsénicoMD | 33 | 15 | 4 | As 4O 6 + 12 H+ + 12 e−}} → 4 As + 6 H 2O |
0.24 | 2.18 | 78 |
| AntimonioMD | 51 | 15 | 5 | Sb 2O 3 + 6 H+ + 6 e−}} → 2 Sb + 3 H 2O |
0.147 | 2.05 | 101 |
| Z número atómico; G grupo; P período; SRP potencial de reducción estándar; EN electronegatividad; EA afinidad electónica | |||||||
| ✣ tradicionalmente considerado un metal noble; MD metaloide; ☢ radioactivo | |||||||
La tabla muestra valores importantes para algunos metales. Los metales nobles tienen potenciales positivos altos. La electronegatividad también es clave. Ayuda a saber qué tan noble o reactivo es un metal.
El arsénico y el antimonio son metaloides. Sus formas más estables son metálicas.
La plata se pone negra por el sulfuro de hidrógeno. Esto ocurre en el aire húmedo. La reacción es:
- 2 Ag + H2S + 12O2 → Ag2S + H2O.
Algunos expertos no consideran la plata un metal noble. Esto es porque se corroe en la boca.
Datos curiosos sobre los metales nobles
- El tercer premio en los Juegos Olímpicos es de bronce. El bronce es una mezcla de cobre y estaño. Se creía que era un metal noble, pero no lo es. A pesar de este error, el premio de bronce se sigue usando.
- Algunos metales nobles ya no se usan en rellenos dentales. Ahora se usan materiales de cerámica.
Galería de imágenes
-
Calcopirita, que es sulfuro de cobre y hierro (CuFeS2), es el mineral de cobre más abundante.
-
Acantita, o sulfuro de plata (Ag2S), es el mineral de plata más importante.
-
Pepita de oro de Australia, casi 9000 g o 64 oz.
Véase también
 En inglés: Noble metal Facts for Kids
En inglés: Noble metal Facts for Kids
- Gases nobles (son los equivalentes químicos a los «metales nobles»).
- Corrosión y oxidación
- Semimetal
- Transmutación











