Clorato de sodio para niños
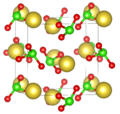
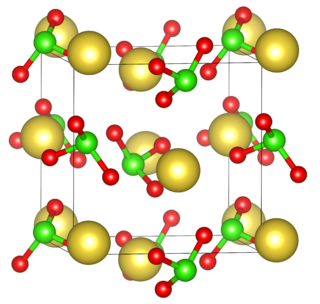
El clorato de sodio (NaClO3) es un compuesto químico que, cuando está puro, se ve como un polvo blanco y cristalino. Se disuelve fácilmente en agua y tiene la característica de absorber humedad del aire, lo que se conoce como ser higroscópico. Cuando se calienta por encima de los 250 °C, se descompone, liberando oxígeno y dejando un residuo de cloruro de sodio (sal común).
Datos para niños
Clorato de sodio |
||
|---|---|---|
 |
||
 |
||
| Nombre IUPAC | ||
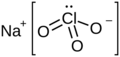
| Clorato de sodio | ||
| General | ||
| Otros nombres | Clorato sódico, clorato (V) de sodio | |
| Fórmula estructural | 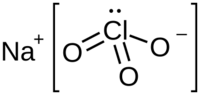 Estructura en Jmol |
|
| Fórmula molecular | NaClO3 | |
| Identificadores | ||
| Número CAS | 7775-09-9 | |
| Número RTECS | FO0525000 | |
| ChemSpider | 22895 | |
| PubChem | 24487 | |
| UNII | T95DR77GMR | |
| KEGG | C18765 | |
|
InChI
InChI=InChI=1S/ClHO3.Na/c2-1(3)4;/h(H,2,3,4);/q;+1/p-1
Key: YZHUMGUJCQRKBT-UHFFFAOYSA-M |
||
| Propiedades físicas | ||
| Apariencia | polvo cristalino blanco, incoloro | |
| Densidad | 2500 kg/m³; 2,5 g/cm³ | |
| Masa molar | 106,44 g/mol | |
| Punto de fusión | 521,15 K (248 °C) | |
| Punto de descomposición | 573 K (300 °C) | |
| Índice de refracción (nD) | 1.572 | |
| Propiedades químicas | ||
| Solubilidad en agua | 101.0 g/100 ml (20 °C) | |
| Peligrosidad | ||
| NFPA 704 |
0
1
2
OX
|
|
| Frases R | R9 R22 R51/53 | |
| Frases S | (S2) S13 S17 S46 S61 | |
| Riesgos | ||
| Ingestión | Dolor abdominal, diarrea, dificultad para respirar, vómito. Enjuagar la boca, atención médica. | |
| Inhalación | Tos, dolor de garganta, azulado de piel, labios, uñas; confusión, convulsiones, mareo, dolor de cabeza, náuseas, inconsciencia. Dar aire fresco, descanso, atención médica. | |
| Piel | Enrojecimiento. Enjuagar con abundante agua, remover ropas contaminadas y enjuagar de nuevo, atención médica. | |
| Ojos | Enrojecimiento, dolor. Enjuagar con abundante agua por varios minutos, atención médica. | |
| LD50 | 1200 mg/kg (ratas, oral) | |
| Compuestos relacionados | ||
| otros aniones | cloruro de sodio hipoclorito de sodio clorito de sodio perclorato de sodio |
|
| otros cationes | clorato de amonio clorato de litio clorato de potasio clorato de cesio |
|
| ácido generador | ácido clórico | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
Contenido
¿Cómo se produce el clorato de sodio?
Fabricación industrial
En la industria, el clorato de sodio se fabrica mediante un proceso llamado electrólisis. Esto implica pasar electricidad a través de una solución caliente de cloruro de sodio. La reacción química que ocurre es la siguiente:
- NaCl + 3H2O → NaClO3 + 3H2
Otros métodos de síntesis
Otra forma de producirlo es haciendo pasar cloro en forma de gas a través de una solución caliente de hidróxido de sodio. Después de esta reacción, el clorato de sodio se purifica usando un método llamado cristalización.
¿Para qué se usa el clorato de sodio?
Blanqueo de materiales
Su uso comercial más importante es para producir dióxido de cloro (ClO2). Este compuesto se utiliza principalmente para blanquear la pulpa de madera, que es la materia prima para fabricar papel. El dióxido de cloro es el agente blanqueador más común en esta industria.
Control de plantas no deseadas
El clorato de sodio también se usa como un herbicida, es decir, un producto para eliminar plantas. No es selectivo, lo que significa que puede dañar casi cualquier tipo de planta al entrar en contacto con sus partes verdes o al ser absorbido por sus raíces.
Se utiliza para controlar plantas como:
- Gloria de la mañana
- Cirsium arvense (cardo)
- Sorghum halepense (zacate Johnson)
- Bambú
- Senecio (flor de la pasión)
- Hypericum perforatum (hierba de San Juan)
Este herbicida se aplica principalmente en terrenos donde no se cultiva nada, como los bordes de carreteras, cercas o zanjas, para eliminar toda la vegetación.
Uso como defoliante y desecante
También se usa para quitar las hojas de las plantas (defoliante) o para secarlas (desecante) antes de la cosecha en cultivos como:
- Algodón
- Arroz
- Cártamo
- Caupí
- Frijoles secos
- Girasoles
- Lino
- Maíz
- Pimientos
- Granos de sorgo
- Granos de soja
Cuando se mezcla con otros herbicidas, como la atrazina o el 2,4-D, puede mejorar su efecto. El clorato de sodio también puede dejar el suelo sin plantas por un tiempo.
Producción de oxígeno en emergencias
Los sistemas de oxígeno de emergencia, como los que se encuentran en los aviones, usan clorato de sodio para generar oxígeno. Esto ocurre cuando el clorato de sodio se descompone a altas temperaturas, liberando oxígeno.
La reacción es:
- 2 NaClO3 → 2 NaCl + 3 O2
En estos sistemas, el clorato de sodio se mezcla con polvo de hierro. Cuando se necesita oxígeno (por ejemplo, al jalar una máscara de emergencia), se activa una carga que enciende la mezcla. La reacción produce más oxígeno del necesario para la combustión.
¿Qué precauciones se deben tener con el clorato de sodio?
Efectos en la salud
El clorato de sodio puede ser perjudicial si se ingiere. Puede causar problemas como dolor de estómago, diarrea, dificultad para respirar y vómitos. Si se inhala, puede provocar tos, dolor de garganta, mareos y dolor de cabeza. Si entra en contacto con la piel o los ojos, puede causar enrojecimiento y dolor. En cualquiera de estos casos, es importante buscar atención médica de inmediato.
Formas y almacenamiento
El clorato de sodio se puede encontrar en forma de polvo, aerosol o gránulos. Es importante saber que las mezclas secas de clorato de sodio con otras sustancias, especialmente materiales orgánicos (como azúcar), azufre, fósforo, metales en polvo o ácidos fuertes, pueden encenderse o explotar. Por esta razón, no debe guardarse en casas para evitar mezclas accidentales.
Algunos productos comerciales de clorato de sodio incluyen sustancias que reducen el riesgo de incendio, aunque su efecto es limitado si se intenta encenderlos a propósito.
Nombres comerciales y situación actual
El clorato de sodio es el ingrediente principal en varios productos comerciales para el control de plantas, como Atlacide, Defol, De-Fol-Ate, Drop-Leaf, Fall, Harvest-Aid, Kusatol, Leafex y Tumbleaf. También puede combinarse con otros herbicidas.
En Estados Unidos, el clorato de sodio fue un herbicida muy usado hasta 2009, cuando se retiró su permiso para ese uso. Sin embargo, sigue siendo utilizado en otras aplicaciones, como la producción de dióxido de cloro para blanqueo de pulpa y papel.
Galería de imágenes
Véase también
 En inglés: Sodium chlorate Facts for Kids
En inglés: Sodium chlorate Facts for Kids