Densidad para niños

La densidad es una medida que nos dice cuánta masa hay en un espacio determinado (su volumen). Imagina que tienes una caja: si la llenas con plumas, pesará poco. Pero si la llenas con piedras, pesará mucho más, aunque el tamaño de la caja sea el mismo. Esto se debe a que las piedras tienen mayor densidad que las plumas.
En física y química, la densidad se representa con la letra griega rho (ρ). Su fórmula es muy sencilla:
Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \rho = \frac {m}{V}
Donde:
- ρ es la densidad.
- m es la masa (la cantidad de materia).
- V es el volumen (el espacio que ocupa).
En el Sistema Internacional de Unidades, la densidad se mide en kilogramos por metro cúbico (kg/m³). También es común verla en kilogramos por litro (kg/L) o gramos por centímetro cúbico (g/cm³).
Contenido
¿Cómo se descubrió la densidad?
La historia de Arquímedes y la corona
Una historia muy famosa cuenta que hace mucho tiempo, un rey llamado Hierón II de Siracusa le pidió a un sabio llamado Arquímedes que descubriera si su nueva corona de oro era de oro puro o si el joyero había mezclado otros metales más baratos. El rey no quería que la corona se dañara.
Arquímedes pensó y pensó. Un día, mientras se bañaba, notó que el nivel del agua subía cuando él entraba en la bañera. ¡Ahí tuvo una idea! Se dio cuenta de que podía usar el agua para medir el volumen de la corona.
Si la corona era de oro puro, su densidad sería muy alta (el oro es muy denso, unos 19300 kg/m³). Si el joyero había añadido otro metal, la densidad de la corona sería menor. Arquímedes podía comparar el volumen de la corona con el de un trozo de oro puro del mismo peso. Si los volúmenes eran diferentes, significaba que la corona no era de oro puro.
Se dice que, al hacer este descubrimiento, Arquímedes salió muy emocionado a compartir su hallazgo, gritando: «¡Eureka! ¡Eureka!» (que en griego significa: ‘¡Lo encontré!’). Por eso, la palabra "eureka" se usa hoy para expresar un momento de gran descubrimiento.
Esta historia fue escrita por primera vez por Marco Vitruvio, dos siglos después de que supuestamente ocurrió. Algunos expertos dudan de su exactitud, pero la idea principal de usar el desplazamiento del agua para medir el volumen es correcta y muy importante.
El principio de Arquímedes
Otra versión de la historia dice que Arquímedes notó que el agua lo empujaba hacia arriba cuando estaba sumergido. Pensó que si pesaba la corona sumergida en agua y, en el otro lado de la balanza, ponía el mismo peso en oro puro también sumergido, la balanza se equilibraría si la corona era de oro. Esto se debe a que el empuje del agua sería igual si ambos objetos tenían el mismo volumen y peso. De esta idea nació el famoso principio de Arquímedes, que explica por qué los objetos flotan o se hunden.
Mucho después, los científicos desarrollaron el concepto de densidad para poder comparar diferentes materiales sin importar las unidades de medida de cada país. Así nació la idea de la "densidad relativa", que comparaba la masa de una sustancia con la de un volumen igual de agua pura.
Tipos de densidad
Existen diferentes maneras de hablar de la densidad, dependiendo de lo que queramos medir.
Densidad absoluta
La densidad absoluta es la que ya mencionamos: la relación entre la masa y el volumen de una sustancia. Es una propiedad que no cambia sin importar la cantidad de sustancia que tengas.
- Fórmula:
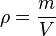
- Unidad en el Sistema Internacional: kilogramo por metro cúbico (kg/m³). También se usa mucho el gramo por centímetro cúbico (g/cm³).
| Símbolo | Nombre |
|---|---|
 |
Densidad |
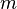 |
Masa |
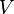 |
Volumen de la sustancia |
Densidad relativa
La densidad relativa compara la densidad de una sustancia con la densidad de otra sustancia que se usa como referencia. Es un número sin unidades, porque es una relación entre dos densidades.
- Fórmula:
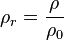
| Símbolo | Nombre |
|---|---|
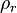 |
Densidad relativa |
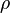 |
Densidad de la sustancia |
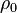 |
Densidad de referencia |
Para líquidos y sólidos, la sustancia de referencia suele ser el agua líquida a 4°C y a la presión normal (1 atmósfera). En esas condiciones, la densidad del agua pura es de 1000 kg/m³ (o 1 kg/L). Para los gases, la referencia suele ser el aire a 0°C y 1 atmósfera.
Densidad media y densidad puntual
Si una sustancia es uniforme en todas sus partes (homogénea), su densidad es la misma en cualquier lugar. Pero si una sustancia no es uniforme (heterogénea), como una roca con diferentes minerales, su densidad puede variar.
- La densidad media se calcula dividiendo la masa total del objeto por su volumen total.
- La densidad puntual se refiere a la densidad en un punto específico del material, que puede ser diferente en cada lugar.
Densidad aparente
La densidad aparente se usa para materiales que tienen espacios vacíos, como el suelo o un ladrillo. Estos espacios pueden estar llenos de aire u otra sustancia. Por eso, la densidad total del material es menor que si estuviera completamente compacto.
Por ejemplo, un muro de ladrillo tiene ladrillos, cemento y aire en los huecos de los ladrillos. Su densidad aparente será la masa total del muro dividida por el volumen total que ocupa, incluyendo los espacios vacíos. La densidad aparente no es una propiedad fija del material, ya que depende de qué tan compacto esté.
¿Cómo cambia la densidad?
La densidad de una sustancia puede cambiar si varían la presión o la temperatura, o si la sustancia cambia de estado (por ejemplo, de líquido a gas).
- Presión: Si aumentamos la presión sobre un material, su densidad generalmente aumenta. Esto es muy notorio en los gases, pero casi imperceptible en líquidos y sólidos.
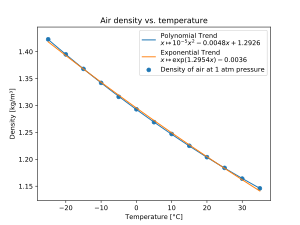
- Temperatura: Como regla general, si la temperatura aumenta, la densidad disminuye (si la presión se mantiene igual). Esto ocurre porque las sustancias se expanden al calentarse. Sin embargo, hay excepciones importantes, como el agua, cuya densidad aumenta entre los 0°C y los 4°C.
- Cambios de estado: Cuando una sustancia cambia de estado (por ejemplo, el agua se convierte en hielo), su densidad también cambia.
Para líquidos y sólidos, los cambios de densidad debido a la presión y la temperatura son muy pequeños, por lo que a menudo se considera que su densidad es constante en muchos cálculos. Sin embargo, la densidad de los gases sí se ve muy afectada por la presión y la temperatura. La ley de los gases ideales explica esta relación: si aumentas la presión de un gas o disminuyes su temperatura, su densidad aumentará.
¿Cómo se mide la densidad?
La densidad se puede medir de dos maneras:
- Indirecta: Se mide la masa y el volumen por separado, y luego se calcula la densidad usando la fórmula (masa/volumen). La masa se mide con una balanza. El volumen se puede medir de varias formas, como calculando el espacio que ocupa un objeto o viendo cuánto líquido desplaza.
- Directa: Se usan instrumentos que miden la densidad directamente.
Instrumentos para medir la densidad
Aquí te presentamos algunos de los instrumentos más comunes:
- Densímetro: Es un instrumento que flota en un líquido y permite leer directamente su densidad. Cuanto más denso es el líquido, más alto flota el densímetro.
- Picnómetro:
Es un pequeño recipiente de vidrio que se usa para medir con mucha precisión la densidad de líquidos, sólidos y gases. Se pesa vacío, luego lleno con la sustancia, y así se calcula su densidad.
- Balanza hidrostática: Se usa para calcular la densidad de sólidos. Se basa en el principio de Arquímedes, midiendo el peso del objeto en el aire y luego sumergido en agua.
- Balanza de Mohr-Westphal: Es una variación de la balanza hidrostática que se usa para medir con precisión la densidad de líquidos.
- Instrumentos digitales: Algunos aparatos modernos usan un tubo en forma de U que vibra. La frecuencia de esta vibración cambia según la densidad del líquido o gas que contiene, permitiendo una medición muy precisa.
Unidades de medida de la densidad
Las unidades más usadas para la densidad son:
- En el Sistema Internacional de Unidades (SI):
* kilogramo por metro cúbico (kg/m³).
- Otras unidades comunes:
* gramo por centímetro cúbico (g/cm³). * kilogramo por litro (kg/L) o kilogramo por decímetro cúbico (kg/dm³). La densidad del agua es aproximadamente 1 kg/L. * gramo por mililitro (g/mL), que es lo mismo que g/cm³. * Para los gases, a menudo se usa el gramo por decímetro cúbico (g/dm³) o gramo por litro (g/L).
- En el Sistema anglosajón de unidades:
* onza por pulgada cúbica (oz/in³) * libra por pie cúbico (lb/ft³) * libra por galón (lb/gal)
Densidad de los elementos químicos
La densidad es una propiedad única para cada elemento químico. Aquí puedes ver una tabla con las densidades de los elementos en condiciones normales de laboratorio (en g·cm⁻³):
| H 0,0709 |
He 0,126 |
||||||||||||||||
| Li 0,534 |
Be 1,848 |
B 2,34 |
C 2 |
N 0,81 |
O 1,14 |
F 1,505 |
Ne 1,2 |
||||||||||
| Na 0,971 |
Mg 1,738 |
Al 2,6989 |
Si 2,33 |
P 1,82 |
S 2,07 |
Cl 1,56 |
Ar 1,4 |
||||||||||
| K 0,89 |
Ca 1,54 |
Sc 2,989 |
Ti 4,51 |
V 6 |
Cr 7,15 |
Mn 7,3 |
Fe 7,874 |
Co 8,9 |
Ni 8,902 |
Cu 8,96 |
Zn 7,134 |
Ga 5,904 |
Ge 5,323 |
As 5,72 |
Se 4,79 |
Br 3,12 |
Kr 2,6 |
| Rb 1,532 |
Sr 2,64 |
Y 4,469 |
Zr 6,52 |
Nb 8,57 |
Mo 10,22 |
Tc 11,5 |
Ru 12,1 |
Rh 12,41 |
Pd 12,02 |
Ag 10,5 |
Cd 8,69 |
In 7,31 |
Sn 7,29 |
Sb 6,68 |
Te 6,23 |
I 4,93 |
Xe 3,06 |
| Cs 1,87 |
Ba 3,62 |
* |
Hf 13,31 |
Ta 16,4 |
W 19,3 |
Re 20,8 |
Os 22,587 |
Ir 22,562 |
Pt 21,45 |
Au 19,3 |
Hg 13,546 |
Tl 11,85 |
Pb 11,35 |
Bi 9,79 |
Po 9,2 |
At | Rn |
| Fr 1,87 |
Ra 5 |
** |
Rf 23,2 |
Db 29,3 |
Sg 35 |
Bh 37,1 |
Hs 40,7 |
Mt 37,4 |
Ds 34,8 |
Rg 28,7 |
Cn | Nh | Fl | Mc | Lv | Ts | Og |
| * |
La 6,145 |
Ce 6,77 |
Pr 6,773 |
Nd 7,008 |
Pm 7,264 |
Sm 7,52 |
Eu 5,244 |
Gd 7,901 |
Tb 8,23 |
Dy 8,551 |
Ho 8,795 |
Er 9,066 |
Tm 9,321 |
Yb 6,9 |
Lu 9,841 |
||
| ** |
Ac 10 |
Th 11,72 |
Pa 15,37 |
U 19,1 |
Np 20,25 |
Pu 19,816 |
Am 12 |
Cm 13,51 |
Bk 13,25 |
Cf 15,1 |
Es 8,84 |
Fm 16,9 |
Md 9,824 |
No 11,4 |
Lr 8,1 |
||
Y aquí, las densidades de los elementos en su punto de fusión (cuando se derriten), también en g·cm⁻³:
| H 0,071 |
He | ||||||||||||||||
| Li 0,512 |
Be 1,69 |
B 2,08 |
C 2,26 |
N | O | F | Ne | ||||||||||
| Na 0,927 |
Mg 1,584 |
Al 2,375 |
Si 2,57 |
P | S 1,819 |
Cl | Ar 1,4 |
||||||||||
| K 0,828 |
Ca 1,378 |
Sc 2,8 |
Ti 4,11 |
V 5,5 |
Cr 6,3 |
Mn 5,95 |
Fe 6,98 |
Co 7,75 |
Ni 7,81 |
Cu 8,02 |
Zn 6,57 |
Ga 6,08 |
Ge 5,6 |
As 5,22 |
Se 3,99 |
Br | Kr |
| Rb 1,46 |
Sr 6,98 |
Y 4,24 |
Zr 5,6 |
Nb | Mo 9,33 |
Tc | Ru 10,65 |
Rh 10,7 |
Pd 10,38 |
Ag 9,32 |
Cd 7,996 |
In 7,02 |
Sn 6,99 |
Sb 6,53 |
Te 5,7 |
I | Xe |
| Cs 1,843 |
Ba 3,338 |
* |
Hf | Ta 15 |
W 17,6 |
Re 18,9 |
Os 20 |
Ir 19 |
Pt 19,77 |
Au 17,31 |
Hg | Tl 11,22 |
Pb 10,66 |
Bi 10,05 |
Po | At | Rn |
| Fr | Ra | ** |
Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| * |
La 5,94 |
Ce 6,55 |
Pr 6,5 |
Nd 6,89 |
Pm | Sm 7,16 |
Eu 5,13 |
Gd 7,4 |
Tb 7,65 |
Dy 8,37 |
Ho 8,34 |
Er 8,86 |
Tm 8,56 |
Yb 6,21 |
Lu 9,3 |
||
| ** |
Ac | Th | Pa | U 17,3 |
Np | Pu 16,63 |
Am 11,7 |
Cm | Bk 18,5 |
Cf | Es | Fm | Md | No | Lr | ||
Galería de imágenes
Véase también
 En inglés: Density Facts for Kids
En inglés: Density Facts for Kids