Carbonato para niños
Los carbonatos son un tipo de sales que se forman a partir del ácido carbónico. Imagina que son como los "ladrillos" de muchos minerales y rocas que encontramos en la naturaleza. Su característica principal es que contienen un grupo especial de átomos llamado anión carbonato (CO32-).
La mayoría de los carbonatos no se disuelven fácilmente en agua, excepto algunos como los que contienen metales alcalinos (como el sodio o el potasio). Esta característica es muy importante en la geología, ya que gracias a ella forman grandes depósitos de rocas.
El carbonato más común es el carbonato cálcico (CaCO3). Lo puedes encontrar en minerales como la calcita y el aragonito. También forma rocas muy conocidas como la caliza, el mármol y la marga. A veces, actúa como un "pegamento natural" en algunas areniscas. Si una parte del calcio en el carbonato cálcico se reemplaza por magnesio, obtenemos la dolomita.
Muchos carbonatos no son estables si se calientan mucho. Cuando esto ocurre, liberan dióxido de carbono y se transforman en óxidos.
Carbonatos: Las Sales de la Tierra
¿Qué son los Carbonatos?
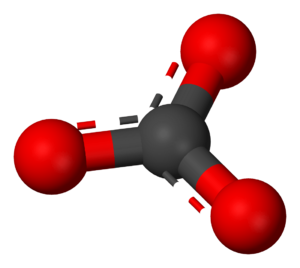
Los carbonatos son compuestos químicos que tienen en su estructura un grupo de átomos llamado ion carbonato (CO32-). Este ion se forma a partir del ácido carbónico (H2CO3). Piensa en ellos como las "sales" de este ácido.
En la naturaleza, los carbonatos se forman cuando el dióxido de carbono del aire se disuelve en el agua, creando ácido carbónico. Este ácido luego reacciona y se transforma en iones bicarbonato y carbonato.
Durante mucho tiempo, los científicos estudiaron cómo se ve el ion carbonato. Gracias a técnicas como los rayos-X, descubrieron que sus tres enlaces con el oxígeno son idénticos, lo que le da una forma plana y muy estable.
¿Por Qué son Importantes los Carbonatos?
Los carbonatos tienen muchísimas aplicaciones en nuestra vida diaria y en la industria:
- Construcción: Minerales como la calcita y la dolomita son esenciales para fabricar cemento y como piedra de construcción.
- Obtención de metales: Algunos minerales de carbonato son fuentes importantes para extraer metales. Por ejemplo, la siderita nos da hierro, la rodocrosita nos da manganeso, y la smithsonita nos da zinc.
- Industria química: El carbonato sódico es muy importante. Se usa para hacer jabón, vidrio y otros productos químicos.
- Limpieza: El percarbonato sódico se usa como blanqueador en detergentes.
- Medicina: El carbonato cálcico es un ingrediente común en las pastas dentales.
- Bases baratas: Los carbonatos también se usan como bases (lo contrario de los ácidos) porque son económicos. Cuando reaccionan con un ácido, liberan dióxido de carbono y agua.
Minerales de Carbonato: Las Rocas que Nos Rodean
Existen alrededor de 80 tipos de minerales carbonatos, aunque la mayoría son poco comunes. Sin embargo, los carbonatos más simples son muy abundantes en la naturaleza. Son el componente principal de rocas como las calizas, las dolomitas y los mármoles. Además, son una fuente importante de muchos metales.
Los minerales de carbonato más conocidos son:
- Calcita (CaCO3)
- Aragonito (CaCO3)
- Dolomita (MgCa(CO3)2)
- Smithsonita (ZnCO3)
- Rodocrosita (MnCO3)
- Magnesita (MgCO3)
Algunos carbonatos, como la malaquita y la azurita, también contienen iones hidróxido en su estructura, lo que les da colores muy llamativos. Los minerales de carbonato suelen ser de dureza media, entre 3 y 5 en la escala de Mohs.
¿Cómo Reaccionan los Carbonatos?
Una de las reacciones más conocidas de los carbonatos es con los ácidos. Cuando un carbonato entra en contacto con un ácido, libera agua y dióxido de carbono. Por ejemplo, si pones ácido clorhídrico en una roca de carbonato cálcico, verás burbujas, que son el dióxido de carbono que se está liberando.
Esta reacción es la base de la "prueba de la efervescencia", que se usa para saber si una muestra contiene carbonatos. Si burbujea al añadir un ácido, ¡es muy probable que sí!
Los carbonatos también se forman en el agua cuando hay metales disueltos y dióxido de carbono. Este proceso es el que da origen a formaciones rocosas impresionantes como las estalactitas y estalagmitas en las cuevas.
Estabilidad Térmica de los Carbonatos
Los carbonatos no soportan muy bien las altas temperaturas. Cuando se calientan, se descomponen, liberando dióxido de carbono y dejando un óxido metálico. Por ejemplo, el carbonato cálcico se descompone en óxido de calcio (conocido como cal viva) y dióxido de carbono cuando se calienta a unos 900 °C. Este proceso se llama calcinación.
La temperatura a la que un carbonato se descompone depende del metal que lo forma. Cuanto más grande es el ion del metal, más estable es el carbonato al calor.
Carbonatos Orgánicos: Más Allá de las Rocas
Además de los carbonatos que forman rocas y minerales, existen los carbonatos orgánicos. Estos son diferentes porque contienen carbono de una manera más compleja, formando ésteres del ácido carbónico.
Un ejemplo muy importante son los policarbonatos. Estos materiales son muy transparentes y resistentes. Se usan para fabricar objetos como los CDs o como un sustituto ligero y seguro del vidrio.
Sales carbonatadas
La siguiente tabla muestra algunos de los carbonatos más comunes, organizados según los elementos de la tabla periódica con los que se combinan. También se indica su peso molecular. Además de los que ves aquí, existen otros como el carbonato amónico.
| 63, 03 H2CO3 |
He |
||||||||||||||||
| 73,89 Li2CO3 |
69,02 BeCO3 |
B |
C |
N |
O |
F |
Ne |
||||||||||
| 105,99 Na2CO3 |
84,31 MgCO3 |
233,99 Al2(CO3)3 |
Si |
P |
S |
Cl |
Ar |
||||||||||
| 138,20 K2CO3 |
100,87 CaCO3 |
Sc |
Ti |
V |
Cr |
114,95 MnCO3 |
115,84 FeCO3 |
118,94 CoCO3 |
118,70 NiCO3 |
123,55 CuCO3 |
125,38 ZnCO3 |
Ga |
Ge |
As |
Se |
Br |
Kr |
| 230,94 Rb2CO3 |
147,63 SrCO3 |
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
275,74 Ag2CO3 |
176,41 CdCO3 |
In |
Sn |
Sb |
Te |
I |
Xe |
| 325,82 Cs2CO3 |
197,34 BaCO3 |
✶ | Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
468,77 Tl2CO3 |
267,21 PbCO3 |
Bi |
Po |
At |
Rn |
Fr |
Ra |
◘ | Rf |
Db |
Sg |
Bh |
Hs |
Mt |
Ds |
Rg |
Cn |
Nh |
Fl |
Mc |
Lv |
Ts |
Og |
| ✶ | Lantánidos | 457,84 La2(CO3)3 |
Ce |
Pr |
Nd |
Pm |
Sm |
Eu |
Gd |
Tb |
Dy |
Ho |
Er |
Tm |
Yb |
Lu |
|
| ◘ | Actínidos | 89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr |
| Alcalinos | Alcalinotérreos | Lantánidos | Actínidos | Metales de transición |
| Metales del bloque p | Metaloides | No metales | Halógenos | Gases nobles y Transactínidos |
Galería de imágenes
-
La química del carbonato y los equilibrios químicos de sus iones derivados juegan un papel fundamental en la formación de los paisajes calcáreos o karsts como el de la Ciudad Encantada de Cuenca, España
-
Agregado de maclas pseudohexagonales de aragonito de unos 4 cm. El aragonito es un mineral de carbonato cálcico con estructura cristalina ortorrómbica.
Véase también
 En inglés: Carbonate Facts for Kids
En inglés: Carbonate Facts for Kids